题目内容
3.把一定量的Na2O2和NaHCO3混合粉末分为两等份,将其中一份加入到200mL稀盐酸中恰好完全反应,生成干燥的气体2.24L(标准状况),再将此气体通入到另一份混合物中,充分反应后,气体减少为2.016L(标准状况),则原混合粉末中Na2O2和NaHCO3的物质的量之比为8:1或2:9;原稀盐酸的物质的量浓度(mol/L)是1.7mol/L或0.65mol/L.分析 第一份发生反应①2Na2O2+4HCl=4NaCl+2H2O+O2 、②NaHCO3+HCl=NaCl+H2O+CO2,生成气体为O2与CO2.将第一份生成的干燥气体,通入第二份Na2O2的NaHCO3的混合粉末,发生反应2Na2O2+2CO2=2Na2CO3+O2,根据气体物质的量差量利用差量法计算参加反应的二氧化碳、过氧化钠的物质的量,再讨论二氧化碳是否过量进行计算.
解答 解:2.24L混合气体的物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,2.016LO2的物质的量为:$\frac{2.016mol/L}{22.4L/mol}$=0.09mol,则:
2Na2O2+2CO2=2Na2CO3+O2 气体物质的量减小△n
2 2 1
n m 0.1mol-0.09mol=0.01mol
则:n=m=0.02mol,
①若CO2完全反应,则第一份生成CO2的为0.02mol,O2为:0.1mol-0.02mol=0.08mol,则:
2Na2O2+4HCl=4NaCl+2H2O+O2
0.16mol 0.32mol 0.08mol
NaHCO3+HCl=NaCl+H2O+CO2
0.02mol 0.02mol 0.02mol,
混合物中过氧化钠与碳酸氢钠的物质的量之比为:0.16mol:0.02mol=8:1;
两个反应中消耗的HCl的物质的量为:0.32mol+0.02mol=0.34mol,则盐酸的物质的量浓度为:$\frac{0.34mol}{0.2L}$=1.7mol/L;
②若CO2未完全反应,则Na2O2应是0.02 mol,
2Na2O2+4HCl=4NaCl+2H2O+O2
0.02mol 0.04mol 0.01mol
则第一份生成O2的为0.01mol,所以CO2为0.1mol-0.01mol=0.09mol,
NaHCO3+HCl=NaCl+H2O+CO2
0.09mol 0.09mol 0.09mol
混合物中过氧化钠与碳酸氢钠的物质的量之比为:0.02mol:0.09mol=2:9;
所以消耗的HCl为 0.04mol+0.09mol=0.13mol,物质的量浓度为:$\frac{0.13mol}{0.2L}$=1.3mol/L,
故答案为:8:1或2:9;1.7mol/L或0.65 mol/L.
点评 本题考查了混合物反应的计算,题目难度较大,明确发生反应的原理为解答关键,注意掌握讨论法在化学计算中的应用方法,试题充分培养了学生的分析、理解能力及化学计算能力.

$\frac{1}{2}$CH4(g)+O2(g)═$\frac{1}{2}$CO2(g)+H2O(l)△H=-445.15kJ•mol-1
CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(l)△H=-607.3kJ•mol-1
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1
CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802.3kJ•mol-1
则CH4的燃烧热为( )
| A. | 445.15 kJ•mol-1 | B. | 607.3 kJ•mol-1 | C. | 890.3 kJ•mol-1 | D. | 802.3 kJ•mol-1 |
| A. | 在稀硫酸存在的条件下可以和2mol乙醇发生酯化反应 | |
| B. | 1mol该有机物与足量金属Na反应生成生成3molH2 | |
| C. | 1mol该有机物最多可与2molNaOH溶液发生反应 | |
| D. | HOOCCH2CH2CH(OH)CH2COOH与该有机物互为同分异构体 |
| A. | x+n | B. | x-n | C. | n | D. | n+2 |
| A. | KClO为氧化剂,反应过程中被还原 | |
| B. | K2FeO4是还原产物 | |
| C. | K2FeO4中Fe为+6价,具有强氧化性,能杀菌消毒 | |
| D. | 若有2 mol FeCl3 发生反应,转移电子的物质的量为 6 mol |
| A. | 1 mol C15H22O5的质量为282g/mol | |
| B. | C15H22O5的摩尔质量等于它的相对分子质量 | |
| C. | 一个C15H22O5微粒的质量约为 $\frac{282}{6.02×1{0}^{23}}$g | |
| D. | 含有6.02×1023个碳原子的C15H22O5的物质的量为1 mol |
| A. | 0.1mol NaOH中含有的阴离子数目为0.1NA | |
| B. | 1L 0.05mol•L-1CH3COOH溶液中含有的H+数目为0.05NA | |
| C. | 标准情况下,44.8L CCl4含有的分子数为2NA | |
| D. | 反应:ClO2-+5Cl-+6H+═3Cl2+3H2O中,每生成1mol Cl2,转移的电子数为2NA |
| t/min | 1 | 2 | 3 | 4 |
| c(N2O5)/mol.L-1 | 0.133 | 0.080 | 0.057 | 0.040 |
| v正/mol.L-1.min-1 | 0.0466 | 0.028 | 0.020 | 0.014 |
| A. | 340K时,速率表达式中m=1 | |
| B. | 340K时,速率表达式中k正≈0.35min-1 | |
| C. | 340K时,若c(N2O3)=0.100mol.L-1,则v正≈0.035mol.L-1.min-1 | |
| D. | 若t=2min时升高温度,则m不变,k正减小 |
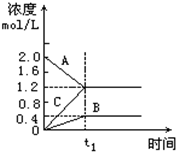 如图表示800℃时A、B、C三种气体物质的浓度随时间的变化情况,t1是到达平衡状态的时间,t1为2分钟.试回答:
如图表示800℃时A、B、C三种气体物质的浓度随时间的变化情况,t1是到达平衡状态的时间,t1为2分钟.试回答: