题目内容
10.把一定量的铁铝合金平均分为两份,分别与足量硫酸和氢氧化钠溶液反应,结果放出H2的物质的量之比是3:1,则合金中铁与铝的物质的量之比为( )| A. | 3:1 | B. | 1:3 | C. | 3:2 | D. | 2:3 |
分析 与足量硫酸和氢氧化钠溶液反应,则金属一定完全反应,设合金中Fe为xmol、Al与ymol,则与硫酸反应时二者均失去电子,与NaOH反应时只有Al失去电子,放出H2的物质的量之比是3:1,则失去电子数之比为3:1,以此来解答.
解答 解:与足量硫酸和氢氧化钠溶液反应,则金属一定完全反应,设合金中Fe为xmol、Al与ymol,则与硫酸反应时二者均失去电子,与NaOH反应时只有Al失去电子,放出H2的物质的量之比是3:1,则失去电子数之比为3:1,则
(2x+3y):3y=3:1,
解得x:y=3:1,
故选A.
点评 本题考查氧化还原反应的计算,为高频考点,把握酸碱足量、电子守恒为解答的关键,侧重分析与计算能力的考查,注意氢气的物质的量比等于失去电子数之比,题目难度不大.

练习册系列答案
相关题目
20.为加速漂白粉的漂白作用,最好的方法是( )
| A. | 加入苛性钠溶液 | B. | 用水湿润 | C. | 加热干燥使用 | D. | 加入少量稀醋酸 |
1.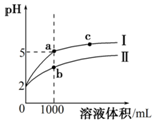 25℃时,pH=2的盐酸和醋酸各1mL分别加水稀释,pH随溶液体积变化的曲线如图所示.下列说法不正确的是( )
25℃时,pH=2的盐酸和醋酸各1mL分别加水稀释,pH随溶液体积变化的曲线如图所示.下列说法不正确的是( )
 25℃时,pH=2的盐酸和醋酸各1mL分别加水稀释,pH随溶液体积变化的曲线如图所示.下列说法不正确的是( )
25℃时,pH=2的盐酸和醋酸各1mL分别加水稀释,pH随溶液体积变化的曲线如图所示.下列说法不正确的是( )| A. | 曲线I代表盐酸的稀释过程 | |
| B. | a溶液的导电性比c溶液的导电性强 | |
| C. | a溶液中和氢氧化钠的能力强于b溶液 | |
| D. | 将a、b两溶液加热至30℃,$\frac{c(C{l}^{-})}{c(C{H}_{3}CO{O}^{-})}$变小 |
18.如图为一种微生物燃料电池结构示意图,下列叙述正确的是( )
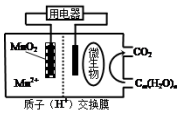

| A. | 放电过程中,电子从正极转移到负极 | |
| B. | 放电过程中,H+从正极区移向负极区 | |
| C. | 正极反应式为:MnO2+4H++2e-=Mn2++2H2O | |
| D. | 若Cm(H2O)n是葡萄糖,当电路中转移了6NA电子时,消耗的葡萄糖是1mol |
5.分类法是一种行之有效、简单易行的科学方法.某同学用下表所示对所学知识进行分类,其中甲与乙、丙、丁是包含关系.下列各组中,正确的组合是( )
| 选项 | 甲 | 乙、丙、丁 |
| A | 纯净物 | 液氯、KAl(SO4)2、CuSO4•5H2O |
| B | 能导电 | Fe、NaCl晶体、AgCl |
| C | 碱 | 一水合氨、NaOH、纯碱 |
| D | 电解质 | 盐酸、硫酸、硝酸 |
| A. | A | B. | B | C. | C | D. | D |
15.下列仪器名称为“蒸馏烧瓶”的是( )
| A. |  | B. |  | C. |  | D. |  |
2.下列说法正确的是( )
| A. |  与 与  是同一种物质,说明苯分子中碳碳双键、碳碳单键交替排列 是同一种物质,说明苯分子中碳碳双键、碳碳单键交替排列 | |
| B. | 等质量的乙烯与乙醇充分燃烧时消耗氧气的质量相等 | |
| C. | 可用溴水鉴别汽油、四氯化碳和乙酸 | |
| D. | 苯和硝酸反应生成硝基苯与甲烷和氯气反应生成一氯甲烷的反应类型不同 |
19.下列说法不正确的是( )
| A. | 硫离子的结构示意图: | |
| B. | 铷、氯、锗三种元素中,适合作半导体材料的是锗 | |
| C. | 氧元素位于第2周期VIA族 | |
| D. | 同周期主族元素随着原子序数的递增,原子半径逐渐减小 |
8.下列有关离子的检验方法一定正确的是( )
| A. | 向某溶液中滴加稀氯化钡溶液,以检验SO42-的存在 | |
| B. | 向某溶液中滴加硝酸银溶液,以检验Cl-的存在 | |
| C. | 向某溶液中滴加热的氢氧化钠溶液,产生的气体能使湿润的石蕊试纸变蓝,以检NH4+ | |
| D. | 用铂丝蘸取某溶液在无色火焰上灼烧直接观察火焰颜色,以检验K+的存在 |