题目内容
3.下列实验能达到目的是( )| A. | 用可见光束照射以区别溶液和胶体 | |
| B. | 用萃取分液的方法出去酒精中的水 | |
| C. | 通过盛有酸性高锰酸钾的洗气瓶除去甲烷中的乙烯 | |
| D. | 只滴加氨水鉴别NaCl MgCl2 AlCl3 Na2SO4 四种无色溶液 |
分析 A.胶体具有丁达尔现象;
B.酒精和水混溶;
C.高锰酸钾与乙烯发生氧化还原反应生成二氧化碳气体;
D.氯化镁、氯化铝和氨水反应生成白色沉淀,和氯化钠、硫酸钠不反应.
解答 解:A.胶体具有丁达尔现象,溶液没有,用可见光束照射以区别溶液和胶体,故A正确;
B.酒精和水混溶不能分层,不能萃取分液,故B错误;
C.高锰酸钾与乙烯发生氧化还原反应生成二氧化碳气体,引入新的杂质,故C错误;
D.氯化镁、氯化铝和氨水反应生成白色沉淀,和氯化钠、硫酸钠不反应,不能鉴别,故D错误.
故选A.
点评 本题考查了物质的分离提纯、鉴别以及胶体性质,掌握基础是关键,题目较简单.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
14.已知反应2SO2(g)+O2(g)?2SO3(g)△H=-198kJ•mol-1,向某体积恒定的密闭容器中充入1mol SO2和0.5molO2,在一定条件下发生反应,下图是某物理量(Y)随时间(t)变化的示意图,下列说法正确的是( )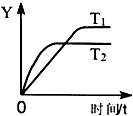

| A. | 温度T2<T1 | |
| B. | 反应达到平衡后放出99kJ的热量 | |
| C. | Y可能是SO2的转化率或SO3的浓度 | |
| D. | 反应达到平衡后容器内气体的密度减小 |
18.下列物质中不属于天然高分子化合物的是( )
| A. | 纤维素 | B. | 蛋白质 | C. | 油脂 | D. | 淀粉 |
8.固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体的最外电子层结构,则下列有关说法不正确的是( )
| A. | NH5中既有共价键又有离子键 | |
| B. | NH5的电子式为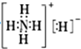 | |
| C. | 1 mol NH5中含有5NA个N-H键(NA表示阿伏加德罗常数) | |
| D. | 它与水反应的离子方程式为NH4++H-+H2O═NH3•H2O+H2↑ |
15. 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成化学式为Z2T的离子化合物.五种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成化学式为Z2T的离子化合物.五种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )
 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成化学式为Z2T的离子化合物.五种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成化学式为Z2T的离子化合物.五种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )| A. | 原子半径和离子半径均满足:Y<Z | |
| B. | 最高价氧化物对应的水化物的酸性:T<R | |
| C. | 气态氢化物的稳定性:Y>T | |
| D. | 由X、Y、Z、T四种元素组成的化合物水溶液一定呈中性 |
12.某溶液中含有下列离子中的五种:Ba2+、Fe2+、Al3+、Fe3+、Mg2+、HCO3-、CO32-、Cl-、NO3-、SO42-,浓度均为0.1mol/L.向其中加入足量的盐酸,有气体生成且反应后溶液中阴离子的种类没有变化.以下分析错误的是( )
| A. | 原溶液中不含HCO3-和CO32- | |
| B. | 向加盐酸后的溶液中再加KSCN溶液,显红色 | |
| C. | 能确定原溶液中的五种离子 | |
| D. | 原溶液中有三种阳离子和两种阴离子 |
13.下列各种关于酸的使用,其中正确的是( )
| A. | 为了抑制Fe2+的水解,用稀硝酸酸化 | |
| B. | 为了增强KMnO4溶液的氧化能力,用浓盐酸酸化 | |
| C. | 检验溶液中是否含有SO42-时,先用盐酸酸化 | |
| D. | 检验氯乙烷中的氯元素,水解后再用硫酸酸化 |
 汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题.
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题.
 .
. ;H:
;H: .
.