题目内容
8.固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体的最外电子层结构,则下列有关说法不正确的是( )| A. | NH5中既有共价键又有离子键 | |
| B. | NH5的电子式为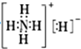 | |
| C. | 1 mol NH5中含有5NA个N-H键(NA表示阿伏加德罗常数) | |
| D. | 它与水反应的离子方程式为NH4++H-+H2O═NH3•H2O+H2↑ |
分析 固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体的最外电子层结构,则存在H-和NH4+,应为NH4H,是一种离子化合物,能与水反应:NH4H+H2O=NH3•H2O+H2↑,有氨气生成,据此解答.
解答 解:A.NH5中存在铵根离子和H-,为离子化合物,铵根离子中含N-H共价键,故A正确;
B.NH5中存在铵根离子和H-,电子式为: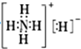 ,故B正确;
,故B正确;
C.NH5中存在铵根离子和H-,为离子化合物,铵根离子中含N-H共价键,1mol NH5中含有4mol N-H键,故C错误;
D.NH5与水反应:NH4H+H2O=NH3•H2O+H2↑,离子方程式:NH4++H-+H2O═NH3•H2O+H2↑,故D正确;
故选:C.
点评 本题考查NH5的组成和性质,利用信息得出物质的结构为解答的关键,注意离子键与共价键区别,题目难度中等.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
3.下列实验能达到目的是( )
| A. | 用可见光束照射以区别溶液和胶体 | |
| B. | 用萃取分液的方法出去酒精中的水 | |
| C. | 通过盛有酸性高锰酸钾的洗气瓶除去甲烷中的乙烯 | |
| D. | 只滴加氨水鉴别NaCl MgCl2 AlCl3 Na2SO4 四种无色溶液 |
13.一种“即食即热快餐”适合外出旅行时使用.其内层是用铝箔包裹的,并已加工好的真空包装食品.外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两包的化学物质反应,此时便可以对食物进行加热,这两包化学物质最合适的选择是( )
| A. | 硫酸与水 | B. | 氯化钠与水 | C. | 熟石灰与水 | D. | 生石灰与水 |
20.某一可逆反应的反应物和生成物都是气体,改变下列条件一定能使化学平衡向正反应方向移动的是( )
| A. | 恒压下充入稀有气体 | B. | 减小反应容器的体积 | ||
| C. | 升高反应温度 | D. | 分离出生成物 |
18.下列物质不能使品红溶液褪色的是( )
| A. | 氯气 | B. | 过氧化钠 | C. | 次氯酸钠 | D. | 氢氧化钠 |
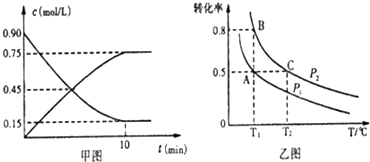 硫及其化合物有广泛应用.
硫及其化合物有广泛应用.
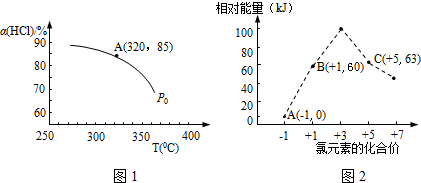
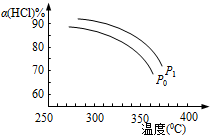 ,增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大.
,增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大.