题目内容
15. 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成化学式为Z2T的离子化合物.五种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成化学式为Z2T的离子化合物.五种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )| A. | 原子半径和离子半径均满足:Y<Z | |
| B. | 最高价氧化物对应的水化物的酸性:T<R | |
| C. | 气态氢化物的稳定性:Y>T | |
| D. | 由X、Y、Z、T四种元素组成的化合物水溶液一定呈中性 |
分析 短周期主族元素中,R原子最外层电子数是电子层数的2倍,可能为C或S,由图中原子半径和原子序数关系可知R应为C;Y与Z能形成Z2Y、Z2Y2型离子化合物,应为Na2O、Na2O2,则Y为O,Z为Na;Z与T形成的Z2T化合物,则T应为S,X的原子半径最小,原子序数最小,则X为H元素,据此解答.
解答 解:短周期主族元素中,R原子最外层电子数是电子层数的2倍,可能为C或S,由图中原子半径和原子序数关系可知R应为C;Y与Z能形成Z2Y、Z2Y2型离子化合物,应为Na2O、Na2O2,则Y为O,Z为Na;Z与T形成的Z2T化合物,则T应为S,X的原子半径最小,原子序数最小,则X为H元素.
A.原子半径O>Na,离子半径O2->Na+,故A错误;
B.非金属性S>C,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故B错误;
C.非金属性O>S,故氢化物稳定性:H2O>H2S,故C正确;
D.由H、C、O、Na四种元素组成的化合物不仅仅为NaHCO3,可能为有机盐且含有羧基,溶液不一定为碱性,可能为酸性,故D错误.
故选C.
点评 本题考查结构性质位置关系应用,侧重于学生的分析能力的考查,推断元素是解题的关键,D为易错点,学生容易忽略有机物,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.根据要求完成下列各小题实验.(a、b为弹簧夹,加热及固定装置已略去)
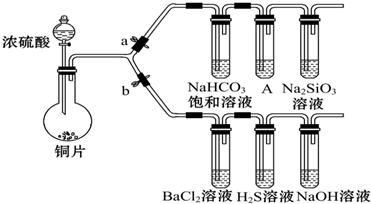
(1)验证SO2的氧化性、还原性和酸性氧化物的通性.
①若大量的SO2通入NaOH溶液中,其离子方程式是:SO2+NaOH═NaHSO3
②打开b,关闭a.能验证SO2具有氧化性的化学方程式是:2H2S+SO2═3S↓+2H2O.
③BaCl2溶液中无沉淀现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置.
写出其中SO2显示还原性并生成沉淀的离子方程式Ba2++SO2+Cl2+2H2O═BaSO4↓+4H++2Cl-.
(2)验证碳、硅非金属性的相对强弱.(已知酸性:亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,装置A中的试剂是酸性KMnO4溶液.
②连接仪器、检验装置的气密性、加药品后,打开a关闭b,然后滴入浓硫酸,加热.
③能说明碳的非金属性比硅强的实验现象是:A中酸性KMnO4溶液不退色,Na2SiO3溶液中出现白色沉淀.

(1)验证SO2的氧化性、还原性和酸性氧化物的通性.
①若大量的SO2通入NaOH溶液中,其离子方程式是:SO2+NaOH═NaHSO3
②打开b,关闭a.能验证SO2具有氧化性的化学方程式是:2H2S+SO2═3S↓+2H2O.
③BaCl2溶液中无沉淀现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置.
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 |
(2)验证碳、硅非金属性的相对强弱.(已知酸性:亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,装置A中的试剂是酸性KMnO4溶液.
②连接仪器、检验装置的气密性、加药品后,打开a关闭b,然后滴入浓硫酸,加热.
③能说明碳的非金属性比硅强的实验现象是:A中酸性KMnO4溶液不退色,Na2SiO3溶液中出现白色沉淀.
6.关于胡椒酚( ,植物挥发油中成分)说法正确的是( )
,植物挥发油中成分)说法正确的是( )
 ,植物挥发油中成分)说法正确的是( )
,植物挥发油中成分)说法正确的是( )| A. | 该化合物属于芳香烃 | |
| B. | 分子中9个碳原子一定处于同一平面 | |
| C. | 它的部分同分异构体能够发生银镜反应 | |
| D. | 1 mol该有机物最多可与2 mol Br2 发生反应 |
3.下列实验能达到目的是( )
| A. | 用可见光束照射以区别溶液和胶体 | |
| B. | 用萃取分液的方法出去酒精中的水 | |
| C. | 通过盛有酸性高锰酸钾的洗气瓶除去甲烷中的乙烯 | |
| D. | 只滴加氨水鉴别NaCl MgCl2 AlCl3 Na2SO4 四种无色溶液 |
10.在光照条件下,CH4与Cl2能发生取代反应:若将1 mol CH4与Cl2反应,待反应完成后测得四种有机取代物的物质的量之比为:n(CH3Cl):n(CH2Cl2):n(CHCl3):n(CCl4)=4:3:2:1,则消耗的Cl2为( )
| A. | 1.0 mol | B. | 2.0 mol | C. | 3.0 mol | D. | 4.0 mol |
20.某一可逆反应的反应物和生成物都是气体,改变下列条件一定能使化学平衡向正反应方向移动的是( )
| A. | 恒压下充入稀有气体 | B. | 减小反应容器的体积 | ||
| C. | 升高反应温度 | D. | 分离出生成物 |
7.下列各组数据比较,前者比后者小的是( )
| A. | 氯水与氨水中微粒种类 | B. | 乙烷与苯分子中碳碳键键长 | ||
| C. | 氯化铯与氯化钠的熔点 | D. | Al2O3与AlCl3的熔点 |
4.下列物质中既属于芳香化合物又属于醇的是( )
| A. |  | B. |  | C. |  | D. | CH3CH2OH |
5.下列离子方程式书写正确的是( )
| A. | 铁与氯化铁溶液反应:Fe+Fe3+═2Fe2+ | |
| B. | 氯化铝溶液与足量的氢氧化钠溶液反应:Al3++3OH-═Al(OH)3↓ | |
| C. | 氯气与氢氧化钠溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 碳酸氢钠溶液与稀盐酸反应:2H++CO32-═CO2↑+H2O |