题目内容
8. 在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图:
在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图:(1)比较t2时刻,正逆反应速率大小V正> V逆.(填“>”、“=”、“<”)
(2)若t2=2min,计算反应开始至t2时刻用M的浓度变化表示的平均反应速率为:0.25mol/(L•min).
(3)t3时刻化学反应达到平衡,反应物的转化率为75%.
(4)如果升高温度,则V逆增大(填增大、减小或不变).
分析 (1)根据图可知,在t2时刻气体N的物质的量在减小,M的物质的量在增加,所以反应在向正反应方向进行,此时V正>V逆,据此答题;
(2)根据v=$\frac{△c}{△t}$计算反应速率;
(3)根据图可知,从反应开始N的物质的量在减小,所以N为反应物,根据转化率=$\frac{消耗量}{起始量}$×100%计算;
(4)升高温度反应速率增大,据此答题;
解答 解:(1)根据图可知,在t2时刻气体N的物质的量在减小,M的物质的量在增加,所以反应在向正反应方向进行,此时V正>V逆,
故答案为:>;
(2)根据v=$\frac{△c}{△t}$计算得M的平均化学反应速率为$\frac{\frac{4mol-2mol}{4L}}{2min}$mol/(L•min)=0.25mol/(L•min),故答案为:0.25mol/(L•min);
(3)根据图可知,从反应开始N的物质的量在减小,所以N为反应物,根据转化率=$\frac{消耗量}{起始量}$×100%计算得N的转化率为$\frac{8mol-2mol}{8mol}$×100%=75%,
故答案为:75%;
(4)升高温度可逆反应中的正逆反应速率都增大,故答案为:增大;
点评 本题主要考查了化学反应速率的计算、转化率的计算、影响化学反应速率的因素等知识点,难度不大,解题时注意基础知识的灵活运用.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
12.在C6H6、C8H8、C2H2O2组成的混合物中,已知氧元素的质量分数为9%,则混合物中碳元素的质量分数是( )
| A. | 92.3% | B. | 87.6% | C. | 75% | D. | 84% |
13.0.2mo1•L-1的NH4Cl溶液与0.1mol•L-1NaOH溶液等体积混合.下列判断正确的是( )
| A. | 所得溶液中存在等式:c(NH4+)+c(Na+)=c(Cl-)+c(OH-) | |
| B. | 所得溶液显碱性,且c(NH4+)<c(NH3•H2O) | |
| C. | 溶液中存在等式:c(NH4+)+c(NH3•H2O)=c(Cl-) | |
| D. | 溶液中c(Na+)=0.1mol•L-1 |
16.在冰醋酸、葡萄糖、甲酸甲酯的混合物中,含碳的质量分数为( )
| A. | 30% | B. | 40% | C. | 50% | D. | 无法确定 |
3.从柑橘中可提炼得到1,8-萜二烯: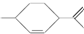 ,下列有关该有机物的说法中不正确的是( )
,下列有关该有机物的说法中不正确的是( )
 ,下列有关该有机物的说法中不正确的是( )
,下列有关该有机物的说法中不正确的是( )| A. | 分子式为C10H18 | |
| B. | 常温下呈液态,难溶于水 | |
| C. | 1 mol该有机物最多能和2mol H2发生加成反应 | |
| D. | 该有机物能与溴水发生取代反应 |
13.下列有关化学用语表示正确的是( )
| A. | Al3+的结构示意图: | |
| B. | 甲酸甲酯的结构简式:C2H4O2 | |
| C. | 醋酸的电离方程式:CH3COOH═CH3COO-+H+ | |
| D. | 中子数为145、质子数为94的钚(Pu)原子:${\;}_{94}^{145}$Pu |
17.如表给出了X、Y、Z、W四种短周期元素的部分信息,请根据这些信息判断下列说法中正确的是( )
| 元素 | X | Y | Z | W |
| 原子半径/nm | 0.102 | 0.16 | 0.074 | 0.071 |
| 最高正价或最低负价 | +6 | +2 | -2 | -1 |
| A. | 原子序数X>Y>W>Z | B. | 纯净的X与纯净的Z反应生成XZ3 | ||
| C. | Z的最高正价为+6 | D. | HZ是热稳定性最强的氢化物 |

 )发生缩聚反应产物的结构简式为
)发生缩聚反应产物的结构简式为 ;
; 有机物Ⅱ的结构简式为CH3C≡CCH=CHCH2CH3;A、B可以发生类似①的反应生成有机物Ⅰ,则该反应的化学方程式为CH3C≡CH+CH3CH2CHO$\stackrel{催化剂}{→}$CH3C≡CCH(OH)CH2CH2CH3.
有机物Ⅱ的结构简式为CH3C≡CCH=CHCH2CH3;A、B可以发生类似①的反应生成有机物Ⅰ,则该反应的化学方程式为CH3C≡CH+CH3CH2CHO$\stackrel{催化剂}{→}$CH3C≡CCH(OH)CH2CH2CH3.