题目内容
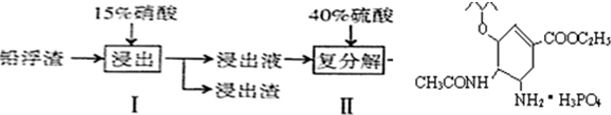
硫酸铅广泛应用于制造蓄电池、白色颜料等.利用锌冶炼过程中的铅浮渣(铅浮渣的主要成分是PbO、Pb还含有少量的Ag、Zn、CaO和其他不溶于硝酸的杂质)生产硫酸铅的流程如下:
下表是25°C时某些盐的浓度积常数,
下列说法不正确的是( )

下表是25°C时某些盐的浓度积常数,
| 化学式 | CaSO4 | Ag2SO4 | PbSO4 |
| Ksp | 4.9×10-5 | 1.2×10-5 | 1.6×10-8 |
| A、步骤I有NO产生,浸出液中含量最多的金属阳离子为Pb2+ |
| B、步骤I需控制硝酸的用量并使Pb稍有剩余,其目的是防止Ag被溶解进入溶液 |
| C、母液可循环利用于步骤I,其溶质主要是Pb(NO3)2 |
| D、产品PbSO4还需用Pb(NO3)2溶液多次洗涤,目的是除去CaSO4 |
考点:难溶电解质的溶解平衡及沉淀转化的本质,物质的分离、提纯的基本方法选择与应用
专题:电离平衡与溶液的pH专题
分析:A、稀硝酸与金属单质生成NO;
B、若硝酸过量则会生成硝酸银;
C、Pb(NO3)2溶液加硫酸后生成硫酸铅沉淀和硝酸;
D、硫酸钙微溶,易沉淀在PbSO4表面,要进行洗涤.
B、若硝酸过量则会生成硝酸银;
C、Pb(NO3)2溶液加硫酸后生成硫酸铅沉淀和硝酸;
D、硫酸钙微溶,易沉淀在PbSO4表面,要进行洗涤.
解答:
解:A、铅浮渣的主要成分是PbO、Pb还含有少量的Ag、Zn、CaO,加稀硝酸后,稀硝酸与金属单质反应能生成NO和Pb2+,以及少量的其它金属阳离子,故A正确;
B、若硝酸过量,则过量的硝酸会和银反应生成硝酸银,产品中会有杂质,所以步骤I需控制硝酸的用量并使Pb稍有剩余,其目的是防止Ag被溶解进入溶液,故B正确;
C、Pb(NO3)2溶液加硫酸后生成硫酸铅沉淀和硝酸,所以母液可循环利用于步骤I,其溶质主要是HNO3,故C错误;
D、硫酸钙微溶,易沉淀在PbSO4表面,所以需用Pb(NO3)2溶液多次洗涤,除去CaSO4,故D正确;
故选C.
B、若硝酸过量,则过量的硝酸会和银反应生成硝酸银,产品中会有杂质,所以步骤I需控制硝酸的用量并使Pb稍有剩余,其目的是防止Ag被溶解进入溶液,故B正确;
C、Pb(NO3)2溶液加硫酸后生成硫酸铅沉淀和硝酸,所以母液可循环利用于步骤I,其溶质主要是HNO3,故C错误;
D、硫酸钙微溶,易沉淀在PbSO4表面,所以需用Pb(NO3)2溶液多次洗涤,除去CaSO4,故D正确;
故选C.
点评:本题考查了生产硫酸铅的工艺流程、硝酸的性质等,还涉及基本的实验操作,考查学生分析问题和解决问题的能力,题目难度中等.

练习册系列答案
相关题目
通过一个阶段的复习,你认为下列说法正确的是( )
| A、在氧化还原反应中,一种元素被氧化的同时一定有另一种元素被还原 |
| B、在101KPa下,1mol物质完全燃烧的反应热叫做该物质的热值 |
| C、在化合物中,不是电解质就是非电解质 |
| D、对于可逆反应,温度升高则该反应的平衡常数一定增大 |
取两份等质量的铝分别溶于足量硫酸、足量氢氧化钠溶液中,完全反应后收集到(标准状况下)氢气体积比为( )
| A、1:1 | B、1:2 |
| C、3:2 | D、2:3 |
下列叙述正确的是( )
| A、用乙醇或CCl4均可提取碘水中的碘单质 |
| B、NaCl和SiC晶体熔化时,克服粒子间作用力的类型相同 |
| C、二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
| D、24Mg32S晶体中电子总数与中子总数之比为1:1 |
含有相同氧原子数的NO2和NO的物质的量之比为( )
| A、1:1 | B、1:2 |
| C、2:3 | D、2:1 |
下列叙述正确的是( )
| A、发生化学反应时失去电子越多的金属原子,还原能力越强 |
| B、金属阳离子被还原后,一定得到金属的单质 |
| C、电离时能生成H+的化合物一定是酸 |
| D、能与酸反应的氧化物,不一定是碱性氧化物 |
下列关于阿伏加德罗常数的说法正确的是( )
| A、阿伏加德罗常数是一个纯数,没有单位 |
| B、阿伏加德罗常数就是6.02×1023 |
| C、阿伏加德罗常数是指1mol的任何粒子的粒子数 |
| D、阿伏加德罗常数的值为:6.02×1023mol-1 |