题目内容
下列叙述正确的是( )
| A、用乙醇或CCl4均可提取碘水中的碘单质 |
| B、NaCl和SiC晶体熔化时,克服粒子间作用力的类型相同 |
| C、二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
| D、24Mg32S晶体中电子总数与中子总数之比为1:1 |
考点:分液和萃取,原子构成,不同晶体的结构微粒及微粒间作用力的区别,硅和二氧化硅
专题:
分析:A.酒精和水互溶;
B.NaCl是离子晶体,SiC晶体是原子晶体;
C.二氧化硅能与HF反应;
D.中子数=质量数-质子数.
B.NaCl是离子晶体,SiC晶体是原子晶体;
C.二氧化硅能与HF反应;
D.中子数=质量数-质子数.
解答:
解:A.酒精和水互溶,不分层,不能做萃取剂,故A错误;
B.NaCl是离子晶体,SiC晶体是原子晶体,克服粒子间作用力分别为离子键、共价键,故B错误;
C.二氧化硅能与HF反应生成四氟化硅气体,故C错误;
D.24Mg32S晶体中电子总数与中子总数都为28,故D正确.
故选D.
B.NaCl是离子晶体,SiC晶体是原子晶体,克服粒子间作用力分别为离子键、共价键,故B错误;
C.二氧化硅能与HF反应生成四氟化硅气体,故C错误;
D.24Mg32S晶体中电子总数与中子总数都为28,故D正确.
故选D.
点评:本题考查萃取、晶体类型、硅及其化合物和原子结构,涉及内容较多,题目难度不大.

练习册系列答案
相关题目
若1gN2中含有x个分子,则阿伏加德罗常数是( )
A、
| ||
B、
| ||
| C、14x mol-1 | ||
| D、28x mol-1 |
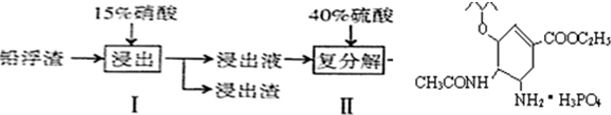
硫酸铅广泛应用于制造蓄电池、白色颜料等.利用锌冶炼过程中的铅浮渣(铅浮渣的主要成分是PbO、Pb还含有少量的Ag、Zn、CaO和其他不溶于硝酸的杂质)生产硫酸铅的流程如下:
下表是25°C时某些盐的浓度积常数,
下列说法不正确的是( )

下表是25°C时某些盐的浓度积常数,
| 化学式 | CaSO4 | Ag2SO4 | PbSO4 |
| Ksp | 4.9×10-5 | 1.2×10-5 | 1.6×10-8 |
| A、步骤I有NO产生,浸出液中含量最多的金属阳离子为Pb2+ |
| B、步骤I需控制硝酸的用量并使Pb稍有剩余,其目的是防止Ag被溶解进入溶液 |
| C、母液可循环利用于步骤I,其溶质主要是Pb(NO3)2 |
| D、产品PbSO4还需用Pb(NO3)2溶液多次洗涤,目的是除去CaSO4 |
下列说法正确的是( )
| A、构成单质分子的微粒一定含有共价键 |
| B、熔融时能导电的化合物,一定是离子化合物 |
| C、水加热至1000℃也不分解,是由于水分子间存在氢键 |
| D、由H原子形成1mol H-H键所要吸收的能量就等于H-H的键能 |
下列气体在同温度、同体积、同质量时,压强最大的是( )
| A、CO2 |
| B、CO |
| C、CH4 |
| D、H2 |
将下列各组物质按混合物、碱、酸性氧化物分类顺次排列,其中正确的是( )
| A、漂白粉 NaOH SO2 |
| B、氯水 纯碱 SO2 |
| C、空气 CuSO4 CaO |
| D、酒精 Na2O CO |
下列说法正确的是( )
| A、等质量的乙烯和丙烯中,所含碳原子数之比为2:3 |
| B、等体积、等浓度的NH4Cl溶液和稀氨水中,所含NH4+的数目相等 |
| C、等物质的量的过氧化钡(BaO2)和Ba(OH)2固体中,阴阳离子个数比均为2:1 |
| D、等物质的量的Cl2分别与足量的Fe和Cu反应,转移的电子数相等 |
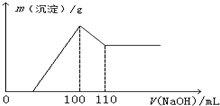 某学生课外兴趣小组为研究某镁铝合金的成分,用天平称取0.51g该合金,溶于100mL盐酸,形成无色溶液,然后逐滴加入1mol?L-1 NaOH溶液,生成沉淀质量随NaOH溶液体积变化如图所示.求:
某学生课外兴趣小组为研究某镁铝合金的成分,用天平称取0.51g该合金,溶于100mL盐酸,形成无色溶液,然后逐滴加入1mol?L-1 NaOH溶液,生成沉淀质量随NaOH溶液体积变化如图所示.求: