题目内容
10.下列离子方程式中能表示多个化学反应的是( )①Fe+Cu2+═Fe2++Cu ②Ba2++OH-+H++SO42-═BaSO4↓+H2O
③Ba2++OH-+H++SO42-═BaSO4↓+2H2O ④Cl2+H2O═H+Cl-+HClO
⑤CO32-+2H+═CO2+H2O ⑥Ag++Cl-═AgCl↓
| A. | ①②⑤⑥ | B. | ①②③⑤⑥ | C. | ③④ | D. | 只有④ |
分析 ①铜离子对应的盐可以是硝酸铜、硫酸铜等;
②该反应可以表示氢氧化钡与过量硫酸氢钠、硫酸氢钾等的反应;
③该反应可以为氢氧化钡与可溶性硫酸氢盐的反应;
④该反应只表示氯气与水的反应;
⑤不反应表示可溶性碳酸盐与强酸的反应;
⑥该反应为硝酸银与可溶性盐酸盐的反应.
解答 解:①Fe+Cu2+═Fe2++Cu中铜离子可以是硫化铜、硫酸铜、硝酸铜等,该离子方程式中能表示多个化学反应,故①正确;
②Ba2++OH-+H++SO42-═BaSO4↓+H2O可以表示氢氧化钡与过量可溶性硫酸氢钠、硫酸氢钾等的反应,故②正确;
③Ba2++OH-+H++SO42-═BaSO4↓+2H2O可表示强碱氢氧化钡与过量硫酸氢钠、硫酸氢钾等的反应,满足条件,故③正确;
④Cl2+H2O═H+Cl-+HClO只表示氯气与水的反应,不满足条件,故④错误;
⑤CO32-+2H+═CO2+H2O可表示碳酸钠、碳酸钾与强酸(硝酸、硫酸、盐酸)之间的多个反应,故⑤正确;
⑥Ag++Cl-═AgCl↓表示硝酸银与氯化钠、氯化钾、氯化钡等多个反应,故⑥正确;
故选B.
点评 本题考查了离子方程式的书写方法,为高考的高频题,题目难度中等,明确离子方程式表示的意义为解答关键,注意熟练掌握离子方程式的书写原则,试题培养了学生的规范答题能力.

练习册系列答案
相关题目
20.在下列反应中,生成物的能量总和高于反应物的能量总和的是( )
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)放热反应 | |
| B. | 2CO(g)+O2(g)═2CO2(g) 放热反应 | |
| C. | CaCO3(s)═CaO(s)+CO2(g)吸热反应 | |
| D. | H+(aq)+OH-(aq)═H2O(l)放热反应 |
1.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,11.2LSO3所含的分子数为0.5NA | |
| B. | 12g石墨和C60的混合物中质子总数一定为6NA | |
| C. | 25℃时,1L mol•L-1FeCl3溶液中含有0.1NA个Fe(OH)3胶体粒子 | |
| D. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA |
18.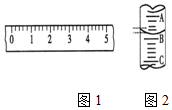 (1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在表中填空,表示称量过程,并在如图1所示的游码尺上画出游码的位置(画“|”表示).
(1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在表中填空,表示称量过程,并在如图1所示的游码尺上画出游码的位置(画“|”表示).
(2)图2表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,量筒中的液体的体积是3.2mL.
(3)用18mol•L-1的硫酸溶液配制0.5mol•L-1的硫酸溶液250mL所需的玻璃仪器为10mL量筒,250ml容量瓶,烧杯,玻璃棒,胶头滴管.
 (1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在表中填空,表示称量过程,并在如图1所示的游码尺上画出游码的位置(画“|”表示).
(1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在表中填空,表示称量过程,并在如图1所示的游码尺上画出游码的位置(画“|”表示).| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 取用砝码情况 |
(3)用18mol•L-1的硫酸溶液配制0.5mol•L-1的硫酸溶液250mL所需的玻璃仪器为10mL量筒,250ml容量瓶,烧杯,玻璃棒,胶头滴管.
20.下列配合物的水溶液中加入硝酸银不能生成沉淀的是( )
| A. | [Co(NH3)4 Cl2]Cl | B. | [Co(NH3)6]Cl3 | C. | [Cu(NH3)4]Cl2 | D. | [Co(NH3)3 Cl3] |