题目内容
11.已知2A2(g)+B2(g)?2C(g);△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量b kJ.请回答下列问题:(1)比较a>b(填>、=、<)
(2)此反应的平衡常数表达式为K=$\frac{{c}^{2}(C)}{{c}^{2}({A}_{2}).c({B}_{2})}$;
若将反应温度升高到700℃,反应的平衡常数将减小(增大、减小或不变).
(3)若在原来的容器中,只加入2mol C,500℃时充分反应达平衡后,吸收热量ckJ,a、b、c之间满足何种关系b+c=a(用代数式表示).
(4)能说明该反应已经达到平衡状态的是bc(填序号,有一个或多个选项符合题意,下同).
a、v(C)=2v(B2) b、容器内气体压强保持不变
c、v逆(A2)=2v正(B2) d、容器内的气体密度保持不变
(5)为使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a、及时分离出C气体 b、适当升高温度;
c、增大B2的浓度 d、选择高效的催化剂
(6)保持温度不变,按下列比例充入固定容积的容器中,达到平衡后C的浓度仍为w mol/L的是②④⑤.
①4molA+2molB ②2molC ③2molA+1molB+2molC
④1.2molA+0.6molB+0.8molC ⑤1molA+0.5molB+1molC
(7)若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A2和1mol B2,500℃时充分反应达平衡后,放出热量dkJ,则d>b(填>、=、<).
(8)在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g)?C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图.
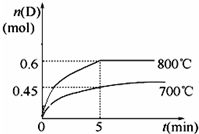
①若最初加入1.0mol A和2.2mol B,利用图中数据计算800℃时的平衡常数K=0.90.9,该反应为吸热反应(填“吸热”或“放热”).
②800℃时,某时刻测得体系中物质的量浓度如下:
c(A)=0.06mol/L,c(B)=0.50mol/L,c(C)=0.20mol/L,c(D)=0.018mol/L,则此时该反应向正方向进行(填“向正方向进行”、“向逆方向进行”或“处于平衡状态”).
分析 (1)2A2(g)+B2(g)?2C(g);△H=-a kJ/mol(a>0)中的a表示2molA2完全反应时放出akJ热量,因为该反应是可逆反应,加入2molA2时,A2反应的物质的量小于2mol;
(2)化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比;该反应的正反应是放热反应,升高温度平衡逆向移动;
(3)相同条件下,2mol C3达到平衡状态时,与加入2mol A2和1mol B2达建立完全相同的平衡状态,即从化学平衡状态到完全反应生成2molC3,放出热量为c kJ;
(4)可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质物质的量、物质的量浓度、百分含量都不变,以及由此引起的一系列物理量不变;
(5)增大反应速率且平衡正向移动,可以通过增大反应物浓度、增大压强实现;
(6)保持温度不变,按下列比例充入固定容积的容器中,达到平衡后C的浓度仍为w mol/L,说明与原来平衡为等效平衡,只要进入的物质完全转化为反应物时应该相当于是2molA2、1molB2;
(7)若将上述容器改为恒压容器(反应前体积相同),与原容器相比相当于增大压强,增大压强平衡正向移动;
(8)①A(g)+2B(g)?C(g)+D(g),
开始(mol)1.0 2.2 0 0
反应(mol)0.6 1.2 0.6 0.6
平衡(mol)0.4 1 0.6 0.6
平衡时c(A)=0.4mol/L、c(B)=1.0mol/L、c(C)=c(D)=0.6mol/L,
化学平衡常数K=$\frac{c(C).c(D)}{c(A).{c}^{2}(B)}$,升高温度平衡向吸热方向移动;
②先计算浓度商,根据浓度商与化学平衡常数相对大小确定反应方向.
解答 解:(1)2A2(g)+B2(g)?2C(g);△H=-a kJ/mol(a>0)中的a表示2molA2完全反应时放出akJ热量,因为该反应是可逆反应,加入2molA2时,A2反应的物质的量小于2mol,所以放出的热量a>b,
故答案为:>;
(2)化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比,该反应平衡常数表达式K=$\frac{{c}^{2}(C)}{{c}^{2}({A}_{2}).c({B}_{2})}$;该反应的正反应是放热反应,升高温度平衡逆向移动,化学平衡常数减小,
故答案为:K=$\frac{{c}^{2}(C)}{{c}^{2}({A}_{2}).c({B}_{2})}$;减小;
(3)相同条件下,2mol C达到平衡状态时,与加入2mol A2和1mol B2达建立完全相同的平衡状态,即从化学平衡状态到完全反应生成2molC,放出热量为c kJ,则b+c=a,
故答案为:b+c=a;
(4)a.v(C)=2v(B2)时,反应速率方向未知,无法判断是否达到平衡状态,故错误;
b.反应前后气体的压强减小,当容器内气体压强保持不变时,各物质的物质的量不变,反应达到平衡状态,故正确;
c.v逆(A2)=2v正(B2)=v正(A2),正逆反应速率相等反应达到平衡状态,故正确;
d.无论反应是否达到平衡状态,容器内的气体密度始终保持不变,不能据此判断平衡状态,故错误;
故选bc;
(5)a、及时分离出C气体,平衡正向移动,但反应速率减小,故错误;
b、适当升高温度,平衡逆向移动,故错误;
c、增大B2的浓度,平衡正向移动且反应速率增大,故正确;
d、选择高效的催化剂,反应速率增大但平衡不移动,故错误;
故选c;
(6)保持温度不变,按下列比例充入固定容积的容器中,达到平衡后C的浓度仍为w mol/L,说明与原来平衡为等效平衡,只要进入的物质完全转化为反应物时应该相当于是2molA2、1molB2,
可以是充入2molC、充入1.2molA+0.6molB+0.8molC或1molA+0.5molB+1molC,
故答案为:②④⑤;
(7)若将上述容器改为恒压容器(反应前体积相同),与原容器相比相当于增大压强,增大压强平衡正向移动,放出的热量大于d>b,
故答案为:>;
(8)①A(g)+2B(g)?C(g)+D(g),
开始(mol)1.0 2.2 0 0
反应(mol)0.6 1.2 0.6 0.6
平衡(mol)0.4 1 0.6 0.6
平衡时c(A)=0.4mol/L、c(B)=1.0mol/L、c(C)=c(D)=0.6mol/L,
化学平衡常数K=$\frac{c(C).c(D)}{c(A).{c}^{2}(B)}$=$\frac{0.6×0.6}{0.4×1.{0}^{2}}$=0.9,
升高温度平衡向吸热方向移动,升高温度D的物质的量增大平衡正向移动,所以该反应的正反应是吸热反应,
故答案为:0.9;吸热;
②该时刻浓度商=$\frac{0.20×0.018}{0.06×(0.50)^{2}}$=0.24<0.9,平衡正向移动,
故答案为:向正方向进行.
点评 本题考查化学平衡计算,为高频考点,涉及浓度商与化学平衡常数计算、等效平衡计算、化学平衡状态判断等知识点,侧重考查学生分析计算能力,难点是等效平衡的建立,题目难度中等.


| A. | 2:7或5:4 | B. | 2:1或5:4 | C. | 4:5或7:2 | D. | 2:1或7:2 |
| A. | 洗涤油污常用热的碳酸钠溶液 | |
| B. | 无法利用Na2S溶液和AlCl3溶液制备Al2S3 | |
| C. | 金属焊接中,可用NH4Cl溶液作除锈剂 | |
| D. | 工业上用FeCl3溶液腐蚀铜制印刷电路板 |
| A. | C2H2 | B. | C3H4 | C. | C3H8 | D. | C4H6 |
 氨气是重要的化工原料.
氨气是重要的化工原料.(1)实验室可用浓氨水和abd(选填编号)快速制取氨气.
a.烧碱 b.生石灰 c.氯化铵d.碱石灰
(2)“侯氏制碱”的核心反应为:
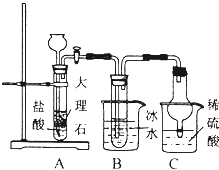
NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3.依据此原理,欲制得碳酸氢钠晶体,某同学设计了如图实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和.
①C装置的作用为防倒吸、吸收过量氨气防污染.
②如表列出的是相关物质在不同温度下的溶解度数据(g/100g水):
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
③该同学在检查完此套装置的气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在AB装置之间(填写字母)连接一个盛有饱和碳酸氢钠溶液的洗气装置,其作用除去二氧化碳气体中的氯化氢气体.
④若该同学进行实验时,所用饱和食盐水中含NaCl的质量为11.7g,实验后得到干燥的NaHCO3晶体的质量为10.92g,则NaHCO3的产率为65%.
(3)往CuSO4溶液中滴加氨水,先有沉淀析出,后沉淀溶解溶液呈深蓝色,有[Cu(NH3)4]2+生成.往溶液中滴加稀硫酸,溶液变为淡蓝色.颜色变浅的原因除溶液变稀外,还可能存在平衡I:[Cu(NH3)4]2+ (深蓝色)+4H+?Cu2+(蓝色)+4NH4+
请设计一个简单实验证明平衡I是否存在往深蓝色溶液中通入少量HCl气体若溶液颜色变浅,证明有平衡Ⅰ的存在,否则不存在(或通入少量氨气或加少量NaOH固体,若溶液颜色变深证明平衡Ⅰ的存在,否则不存在).
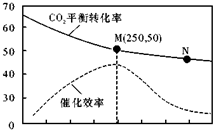 一定条件下合成乙烯6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是( )
一定条件下合成乙烯6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是( )| A. | 生成乙烯的速率:v(M)>v(N) | |
| B. | 平衡常数KM<KN | |
| C. | 催化剂可能会影响CO2的平衡转化率 | |
| D. | 若投料比n(H2):n(CO2)=3:1,则图中M点时,CO2的体积分数约为15.4% |

其中,反应①为:2HCl(g)+CuO(s)?H2O(g)+CuCl2(s)△H1,反应②生成1mol Cl2 (g)的反应热为△H2,则总反应的热化学方程式为2HCl(g)+$\frac{1}{2}$O2(g)$\frac{\underline{\;\;△\;\;}}{\;}$H2O(g)+Cl2(g)△H=△H1+△H2.(反应热用△H1和△H2表示).
(2)一定条件下测得上述反应过程中c(Cl2)的数据如下:
| t(min) | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
| N(Cl2)/10-3(mol/L) | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
(3)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生.

0~tl时,原电池的负极是Al片,此时,正极的电极反应式是2H++NO3-+e-=NO2↑+H2O,溶液中的H+向正极移动,tl时,原电池中电子流动方向发生改变,其原因是铝钝化后,铜成为负极.