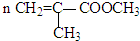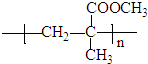题目内容
0.05mol某两种烃的混和物在足量O2中完全充分燃烧,产物依次通过足量浓硫酸和碱石灰,增重分别为2.7g和5.5g.则此混和物可能为( )
| A、CH4 C4H10 |
| B、C2H2 C4H10 |
| C、C2H4 C4H10 |
| D、C2H6 C3H6 |
考点:有关有机物分子式确定的计算,有关混合物反应的计算
专题:烃及其衍生物的燃烧规律
分析:烃完全燃烧生成二氧化碳和水,产物通过足量浓硫酸增重2.7g为水的质量,通过足量碱石灰增重5.5g为二氧化碳质量,计算出水、二氧化碳的物质的量,根据H原子、C原子守恒,计算烃的平均分子组成,据此判断.
解答:
解:烃完全燃烧生成二氧化碳和水,产物通过足量浓硫酸增重2.7g为水的质量,
所以水的物质的量为
=0.15mol;
通过足量碱石灰增重5.5g为二氧化碳质量.
所以二氧化碳的物质的量为
=0.125mol.
所以平均分子组成中碳原子数为:
=2.5,氢原子数为
=6
即平均分子组成为C2.5H6.
A、若CH4和C4H10,由碳原子可知为二者为1:1混合,其平均分子组成中H原子数目为7,由于平均分子组成中含有6个H原子,故A错误;
B、若C2H2和C4H10,由氢原子可知二者为1:1混合,其平均分子组成中C原子数目为3,由于平均分子组成中含有2.5个C原子,故B错误;
C、若C2H4和C4H10,由碳原子可知C2H4和C4H10按3:1混合,由氢原子可知C2H4和C4H10按2:1混合,混合比例不同,故不可能,故C错误;
D、若C2H6和C3H6,由氢原子可知按任意比混合,由碳原子可知为二者为1:1混合,故二者1:1混合,平均分子组成为
C2.5H6,故D正确.
故选:D.
所以水的物质的量为
| 2.7g |
| 18g/mol |
通过足量碱石灰增重5.5g为二氧化碳质量.
所以二氧化碳的物质的量为
| 5.5g |
| 44g/mol |
所以平均分子组成中碳原子数为:
| 0.125mol |
| 0.05mol |
| 0.15mol×2 |
| 0.05mol |
即平均分子组成为C2.5H6.
A、若CH4和C4H10,由碳原子可知为二者为1:1混合,其平均分子组成中H原子数目为7,由于平均分子组成中含有6个H原子,故A错误;
B、若C2H2和C4H10,由氢原子可知二者为1:1混合,其平均分子组成中C原子数目为3,由于平均分子组成中含有2.5个C原子,故B错误;
C、若C2H4和C4H10,由碳原子可知C2H4和C4H10按3:1混合,由氢原子可知C2H4和C4H10按2:1混合,混合比例不同,故不可能,故C错误;
D、若C2H6和C3H6,由氢原子可知按任意比混合,由碳原子可知为二者为1:1混合,故二者1:1混合,平均分子组成为
C2.5H6,故D正确.
故选:D.
点评:考查烃混合物分子式确定,难度较大,注意利用平均分子组成判断烃的组成,常用方法有1、平均碳法 2、平均氢法 3、平均碳氢分子式法 4、平均式量法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 核黄素又称为维生素B2,可促进发育和细胞再生,有利于增进视力,减轻眼睛疲劳.核黄素分子的结构如图所示:已知:
核黄素又称为维生素B2,可促进发育和细胞再生,有利于增进视力,减轻眼睛疲劳.核黄素分子的结构如图所示:已知:
有关核黄素的下列说法中,不正确的是( )
| A、该化合物的分子式为C17H22N4O6 |
| B、酸性条件下加热水解,有CO2生成 |
| C、该分子中有3个手性碳原子(与4个不同基团连接的碳原子叫手性碳原子) |
| D、能发生酯化反应 |
微量元素是指含量在人体总重量的0.01%以下的元素,这些元素对人体的正常发育和健康起着主要作用,下列各组元素全部是微量元素的是( )
| A、Na、K、Cl、S、O |
| B、N、H、O、P、C |
| C、F、I、Fe、Zn、Cu |
| D、Ge、Se、Cu、Mg、C |
现有常温下的四种溶液(如下表),下列有关叙述中正确的是( )
| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
| A、在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变 |
| B、温度下降10℃,四种溶液的pH均不变 |
| C、分别加水稀释10倍,四种溶液的pH:①>②>③>④ |
| D、将①、④两种溶液等体积混合,所得溶液中:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
 将溶液(或气体)X逐渐加入(或通入)到一定量的Y溶液中,产生沉淀(或气体)的物质的量与加入X的物质的量关系如图所示,符合图中情况的一组物质是( )
将溶液(或气体)X逐渐加入(或通入)到一定量的Y溶液中,产生沉淀(或气体)的物质的量与加入X的物质的量关系如图所示,符合图中情况的一组物质是( )