题目内容
25℃时,二元酸H2CO3的溶液中离子种类分布如图,H2CO3、HCO3-、CO32-的浓度总和为为0.1mol?L-1,现有一组Na2CO3和NaHCO3混合溶液,下列有关溶液中离子浓度关系的叙述正确的是( )
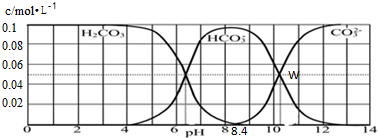

| A、pH=11的溶液中,c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
| B、W点所表示的溶液中:c(Na+)=0.15mol?L-1 |
| C、pH=8.4的溶液中,c(OH-)=c(H+)+c(HCO3-)+2c(CO32-) |
| D、pH=9时,c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) |
考点:离子浓度大小的比较
专题:
分析:A.根据图示可知,当溶液pH=11时,碳酸根离子浓度大于碳酸氢根离子,溶液显示碱性;
B.W点时碳酸的浓度≈0,此时c(HCO3-)=c(CO32-)=0.05mol/L,根据电荷守恒可得:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)判断钠离子浓度;
C.pH=8.4时,氢氧根离子浓度小于10-5mol/L,而此时溶液中主要存在碳酸氢根离子,则碳酸氢根离子浓度≈0.1mol/L>>c(OH-);
D.任何溶液中都存在电荷守恒,根据电荷守恒判断.
B.W点时碳酸的浓度≈0,此时c(HCO3-)=c(CO32-)=0.05mol/L,根据电荷守恒可得:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)判断钠离子浓度;
C.pH=8.4时,氢氧根离子浓度小于10-5mol/L,而此时溶液中主要存在碳酸氢根离子,则碳酸氢根离子浓度≈0.1mol/L>>c(OH-);
D.任何溶液中都存在电荷守恒,根据电荷守恒判断.
解答:
解:A.根据图示曲线变化可知,当溶液pH=11时,CO32-浓度大于HCO3-离子,溶液显示碱性,则溶液中离子浓度大小为:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+),故A错误;
B.W点时碳酸的浓度≈0,此时c(HCO3-)=c(CO32-)=0.05mol/L,根据电荷守恒可得:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),由于此时溶液的pH>10,则c(OH-)>c(H+),c(Na+)>c(HCO3-)+2c(CO32-)=0.15mol/L,故B错误;
C.pH=8.4的溶液中主要存在HCO3-,c(HCO3-)≈0.1mol/L,而pH=8.4时,c(OH-)<10-5mol/L,则:c(OH-)<c(H+)+c(HCO3-)+2c(CO32-),故C错误;
D.碳酸钠和碳酸氢钠的混合液中一定存在电荷守恒:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故D正确;
故选D.
B.W点时碳酸的浓度≈0,此时c(HCO3-)=c(CO32-)=0.05mol/L,根据电荷守恒可得:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),由于此时溶液的pH>10,则c(OH-)>c(H+),c(Na+)>c(HCO3-)+2c(CO32-)=0.15mol/L,故B错误;
C.pH=8.4的溶液中主要存在HCO3-,c(HCO3-)≈0.1mol/L,而pH=8.4时,c(OH-)<10-5mol/L,则:c(OH-)<c(H+)+c(HCO3-)+2c(CO32-),故C错误;
D.碳酸钠和碳酸氢钠的混合液中一定存在电荷守恒:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故D正确;
故选D.
点评:本题考查了酸碱混合的定性判断、溶液中离子浓度定性比较,题目难度中等,正确理解图象中曲线变化为解答关键,注意掌握酸碱混合的定性判断方法,能够根据电荷守恒、物料守恒及盐的水解原理判断溶液中各离子浓度大小.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
①1mol某链烃最多能和2mol HCl发生加成反应,生成1mol氯代烷;②1mol该氯代烷能和8mol Cl2发生取代反应,生成只含碳元素和氯元素的氯代烃.该链烃可能是( )
| A、CH3CH═CH2 |
| B、CH2═CHCH═CH2 |
| C、CH3CH═CHCH3 |
| D、CH3C≡CH |
 已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol/L CH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )
已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol/L CH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )| A、c点表示CH3COOH和NaOH恰好反应完全 | ||
| B、b点表示的溶液中c(CH3COO-)>c(Na+) | ||
| C、a点表示溶液中c(CH3COO-)约为10-3mol/L | ||
D、b、d点表示的溶液中
|
将氯化钠、氯化铝、氯化亚铁、氯化铁、氯化镁五种溶液.只用一种试剂就能加以区别,这种试剂是( )
| A、NaOH |
| B、BaCl2 |
| C、KSCN |
| D、AgNO3 |
铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中不正确的是( )


| A、此过程中涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
| B、此过程中电子从Fe向Cu 转移 |
| C、正极电极反应式为:2H++2e-=H2↑ |
| D、此过程中铜并不被腐蚀 |


 常温下,向100mL 0.01mol?L-1 HA溶液中逐滴加入0.02mol?L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:
常温下,向100mL 0.01mol?L-1 HA溶液中逐滴加入0.02mol?L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题: