题目内容
铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中不正确的是( )


| A、此过程中涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
| B、此过程中电子从Fe向Cu 转移 |
| C、正极电极反应式为:2H++2e-=H2↑ |
| D、此过程中铜并不被腐蚀 |
考点:金属的电化学腐蚀与防护
专题:电化学专题
分析:根据图片知,水中溶解了氧气,铜、铁和水构成了原电池,较活泼的金属作负极,较不活泼的金属作正极,发生吸氧腐蚀,负极上铁失电子发生氧化反应,正极上氧气得电子发生还原反应,原电池放电时,电子从负极流向正极.
解答:
解:根据图片知,水中溶解了氧气,铜、铁和水构成了原电池,较活泼的金属作负极,较不活泼的金属作正极,发生吸氧腐蚀.
A、负极上发生的电极反应式为:Fe-2e-=Fe2+,正极上的电极反应式为:O2+2H2O+4e-=4OH-,亚铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁不稳定,容易被空气中的氧气氧化生成氢氧化铁,反应方程式为:4Fe(OH)2+2H2O+O2=4Fe(OH)3,故A正确;
B、该原电池放电时,外电路上电子从负极铁流向正极铜,故B正确;
C、正极上氧气得电子发生还原反应,电极反应式为:O2+2H2O+4e-=4OH-,故C错误;
D、该原电池中铜作正极,原电池放电时,负极失电子容易被腐蚀,正极被保护,所以铜不被腐蚀,故D正确;
故选C.
A、负极上发生的电极反应式为:Fe-2e-=Fe2+,正极上的电极反应式为:O2+2H2O+4e-=4OH-,亚铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁不稳定,容易被空气中的氧气氧化生成氢氧化铁,反应方程式为:4Fe(OH)2+2H2O+O2=4Fe(OH)3,故A正确;
B、该原电池放电时,外电路上电子从负极铁流向正极铜,故B正确;
C、正极上氧气得电子发生还原反应,电极反应式为:O2+2H2O+4e-=4OH-,故C错误;
D、该原电池中铜作正极,原电池放电时,负极失电子容易被腐蚀,正极被保护,所以铜不被腐蚀,故D正确;
故选C.
点评:本题以原电池原理为载体考查了金属的腐蚀,难度不大,明确钢铁发生析氢腐蚀和吸氧腐蚀的条件是解本题的关键,注意钢铁的吸氧腐蚀中还含有氢氧化亚铁生成氢氧化铁的反应.

练习册系列答案
相关题目
25℃时,二元酸H2CO3的溶液中离子种类分布如图,H2CO3、HCO3-、CO32-的浓度总和为为0.1mol?L-1,现有一组Na2CO3和NaHCO3混合溶液,下列有关溶液中离子浓度关系的叙述正确的是( )
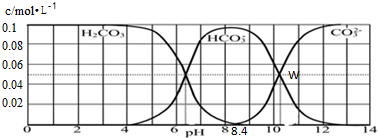

| A、pH=11的溶液中,c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
| B、W点所表示的溶液中:c(Na+)=0.15mol?L-1 |
| C、pH=8.4的溶液中,c(OH-)=c(H+)+c(HCO3-)+2c(CO32-) |
| D、pH=9时,c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) |
25℃时,pH=5的NH4Cl溶液中,由水电离出的OH-浓度是( )
| A、1×10-5mol/L |
| B、1×10-7mol/L |
| C、1×10-9mol/L |
| D、1×10-14mol/L |
下列说法正确的是( )
| A、HR溶液的导电性较弱,所以HR属于弱酸 |
| B、某化合物溶于水导电,该化合物一定是电解质 |
| C、NaCl是电解质,食盐的水溶液也是电解质 |
| D、根据电解质在水溶液中的电离程度,将电解质分为强电解质和弱电解质 |
下列属于糖类的物质有( )
| A、蛋白质 | B、葡萄糖 |
| C、麦芽糖 | D、纤维素 |
某市以保护环境和垃圾资源化为目的,将城市生活垃圾进行分类.下列垃圾属于同类物质的是 ( )
| A、废电池、易拉罐 |
| B、废铜烂铁、塑料袋 |
| C、旧报纸、硬纸板 |
| D、包装塑料、啤酒瓶 |