题目内容
 常温下,向100mL 0.01mol?L-1 HA溶液中逐滴加入0.02mol?L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:
常温下,向100mL 0.01mol?L-1 HA溶液中逐滴加入0.02mol?L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:(1)由图中信息可知HA为
(2)常温下一定浓度的MA稀溶液的pH=a,则a
(3)若此时溶液的pH=10,则c(MOH)+c(OH-)=
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:(1)根据酸的浓度和溶液的PH判断酸的强弱;
(2)根据图示判断出MOH的碱性强弱,再判断MA稀溶液的酸碱性;写出M+离子水解的离子方程式;
(3)根据电荷守恒和物料守恒进行计算.
(2)根据图示判断出MOH的碱性强弱,再判断MA稀溶液的酸碱性;写出M+离子水解的离子方程式;
(3)根据电荷守恒和物料守恒进行计算.
解答:
解:(1)根据图象知,0.01mol?L-1HA溶液中PH=2,氢离子浓度等于酸浓度,所以该酸是强酸,
故答案为:强;0.01mol/L的HA溶液中c(H+)=0.01mol/L,酸完全电离;
(2)N点时溶液呈中性,MOH的物质的量大于HA的物质的量,说明MOH是弱碱,MA属于强酸弱碱盐,水解显示酸性,即a<7;原因是M+离子结合水电离的氢氧根离子生成了MOH,离子方程式为:M++H2O?MOH+H+;
故答案为:<;M++H2O?MOH+H+;
(3)HA是强酸,所以反应后的溶液中,c(A-)=
×0.01mol?L-1=0.005mol?L-1,故c(M+)+c(MOH)=2c(A-);
根据电荷守恒可得:c(H+)+c(M+)=c(A-)+c(OH-),
由c(M+)+c(MOH)=0.01mol/L,可得c(M+)=0.01mol/L-c(MOH),带入电荷守恒公式可得:c(H+)+0.01mol/L-c(MOH)=c(A-)+c(OH-),
整理可得:c(MOH)+c(OH-)=c(H+)+0.01mol/L-c(A-)=10-10mol/L+0.01mol/L-0.005mol?L-1≈0.005mol?L-1,
故答案为:0.005.
故答案为:强;0.01mol/L的HA溶液中c(H+)=0.01mol/L,酸完全电离;
(2)N点时溶液呈中性,MOH的物质的量大于HA的物质的量,说明MOH是弱碱,MA属于强酸弱碱盐,水解显示酸性,即a<7;原因是M+离子结合水电离的氢氧根离子生成了MOH,离子方程式为:M++H2O?MOH+H+;
故答案为:<;M++H2O?MOH+H+;
(3)HA是强酸,所以反应后的溶液中,c(A-)=
| 1 |
| 2 |
根据电荷守恒可得:c(H+)+c(M+)=c(A-)+c(OH-),
由c(M+)+c(MOH)=0.01mol/L,可得c(M+)=0.01mol/L-c(MOH),带入电荷守恒公式可得:c(H+)+0.01mol/L-c(MOH)=c(A-)+c(OH-),
整理可得:c(MOH)+c(OH-)=c(H+)+0.01mol/L-c(A-)=10-10mol/L+0.01mol/L-0.005mol?L-1≈0.005mol?L-1,
故答案为:0.005.
点评:本题考查了弱电解质的电离、盐类的水解、溶液的稀释、离子浓度的大小比较等知识点,利用电荷守恒、物料守恒来分析解答即可,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
25℃时,二元酸H2CO3的溶液中离子种类分布如图,H2CO3、HCO3-、CO32-的浓度总和为为0.1mol?L-1,现有一组Na2CO3和NaHCO3混合溶液,下列有关溶液中离子浓度关系的叙述正确的是( )
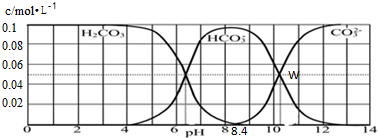

| A、pH=11的溶液中,c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
| B、W点所表示的溶液中:c(Na+)=0.15mol?L-1 |
| C、pH=8.4的溶液中,c(OH-)=c(H+)+c(HCO3-)+2c(CO32-) |
| D、pH=9时,c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) |
下列过程与配合物的形成无关的是( )
| A、向一定量的AgNO3溶液中加入氨水至沉淀消失 |
| B、向FeCl3溶液中加入KSCN溶液 |
| C、向一定量的CuSO4溶液中加入氨水至沉淀消失 |
| D、除去铁粉中的铝粉可以用强碱溶液 |
配制一定体积、一定物质的量浓度的溶液时,下列操作会使配得的溶液浓度偏小的是( )
| A、容量瓶中原有少量蒸馏水 |
| B、定容时观察液面仰视 |
| C、定容时观察液面俯视 |
| D、胶头滴管加水定容时,有少量水滴到容量瓶外 |
为确定某溶液的离子组成,进行实验:根据以上实验,以下对原溶液的推测正确的是( )
①测定溶液的pH值,溶液显碱性;
②取少量溶液加稀盐酸至溶液呈酸性,产生能使澄清石灰水变浑浊的气体;
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀;
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀.
①测定溶液的pH值,溶液显碱性;
②取少量溶液加稀盐酸至溶液呈酸性,产生能使澄清石灰水变浑浊的气体;
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀;
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀.
| A、一定有CO32-离子存在 |
| B、不能确定是否存在HCO3-离子存在 |
| C、一定有C1-离子存在 |
| D、一定有SO32-离子存在 |
下列属于糖类的物质有( )
| A、蛋白质 | B、葡萄糖 |
| C、麦芽糖 | D、纤维素 |