题目内容
某银白色固体A露置在空气中会被氧化成白色固体B;点燃A,火焰呈黄色,生成浅黄色固体C;A、B、C均可跟无色液体D反应,生成碱性物质E;其中A和D反应时还会生成可燃性气体F,C跟D反应时则可生成另一种气体G;F和G混合后遇火可剧烈反应而发生爆炸并生成D.
(1)写出下列物质的化学式:C 、D 、E .
(2)写出A与D反应的离子方程式: .
(3)写出C与D反应的化学方程式: .
(4)写出B与D反应的化学方程式: .
(1)写出下列物质的化学式:C
(2)写出A与D反应的离子方程式:
(3)写出C与D反应的化学方程式:
(4)写出B与D反应的化学方程式:
考点:无机物的推断
专题:
分析:某银白色固体A,放在空气中可氧化成白色固体B,说明可能是活泼金属钠;
将A点燃,火焰呈黄色,生成淡黄色固体C,证明A是Na,燃烧生成的C为过氧化钠Na2O2;
A、B、C三种物质都能跟无色液体D反应,生成碱性物质E判断为NaOH,所以D为H2O,其中A为Na跟D为H2O反应时还可生成可燃性气体F为氢气,C为Na2O2跟D为H2O反应时则生成另一种气体G为O2;
F为氢气和G为O2混合后遇火可剧烈反应而发生爆炸,并生成D为H2O.
将A点燃,火焰呈黄色,生成淡黄色固体C,证明A是Na,燃烧生成的C为过氧化钠Na2O2;
A、B、C三种物质都能跟无色液体D反应,生成碱性物质E判断为NaOH,所以D为H2O,其中A为Na跟D为H2O反应时还可生成可燃性气体F为氢气,C为Na2O2跟D为H2O反应时则生成另一种气体G为O2;
F为氢气和G为O2混合后遇火可剧烈反应而发生爆炸,并生成D为H2O.
解答:
解:某银白色固体A,放在空气中可氧化成白色固体B,说明可能是活泼金属钠;
将A点燃,火焰呈黄色,生成淡黄色固体C,证明A是Na,燃烧生成的C为过氧化钠Na2O2;
A、B、C三种物质都能跟无色液体D反应,生成碱性物质E判断为NaOH,所以D为H2O,其中A为Na跟D为H2O反应时还可生成可燃性气体F为氢气,C为Na2O2跟D为H2O反应时则生成另一种气体G为O2;
F为氢气和G为O2混合后遇火可剧烈反应而发生爆炸,并生成D为H2O;
依据上述分析判断A为Na,B为Na2O,C为Na2O2,D为H2O,E为NaOH,F为H2,G为O2;
(1)依据上述分析判断C为Na2O2,D为H2O,E为NaOH,故答案为:Na2O2;H2O;NaOH;
(2)A与D反应是Na与H2O反应,离子方程式为2Na+2H2O═2Na++2OH-+H2↑,故答案为:2Na+2H2O═2Na++2OH-+H2↑;
(3)C与D反应是Na2O2与H2O的反应,化学方程式为2Na2O2+2H2O═4NaOH+O2↑,故答案为:2Na2O2+2H2O═4NaOH+O2↑;
(4)B与D反应是Na2O与H2O的反应,化学方程式为Na2O+H2O═2NaOH,故答案为:Na2O+H2O═2NaOH.
将A点燃,火焰呈黄色,生成淡黄色固体C,证明A是Na,燃烧生成的C为过氧化钠Na2O2;
A、B、C三种物质都能跟无色液体D反应,生成碱性物质E判断为NaOH,所以D为H2O,其中A为Na跟D为H2O反应时还可生成可燃性气体F为氢气,C为Na2O2跟D为H2O反应时则生成另一种气体G为O2;
F为氢气和G为O2混合后遇火可剧烈反应而发生爆炸,并生成D为H2O;
依据上述分析判断A为Na,B为Na2O,C为Na2O2,D为H2O,E为NaOH,F为H2,G为O2;
(1)依据上述分析判断C为Na2O2,D为H2O,E为NaOH,故答案为:Na2O2;H2O;NaOH;
(2)A与D反应是Na与H2O反应,离子方程式为2Na+2H2O═2Na++2OH-+H2↑,故答案为:2Na+2H2O═2Na++2OH-+H2↑;
(3)C与D反应是Na2O2与H2O的反应,化学方程式为2Na2O2+2H2O═4NaOH+O2↑,故答案为:2Na2O2+2H2O═4NaOH+O2↑;
(4)B与D反应是Na2O与H2O的反应,化学方程式为Na2O+H2O═2NaOH,故答案为:Na2O+H2O═2NaOH.
点评:本题考查了钠及其化合物性质的分析判断,物质性质和反应的现象是解题关键,题目较简单.

练习册系列答案
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
下列除杂所选用的试剂及操作方法均正确的一组是(括号内为杂质)( )
| 选项 | 待提纯的物质 | 选用的试剂 | 操作方法 |
| A | NaCl(Na2CO3) | 盐酸 | 蒸发结晶 |
| B | CO2(CO) | O2 | 点燃 |
| C | Zn (Cu) | 稀硫酸 | 过滤 |
| D | CO2(HCl) | 饱和碳酸钠溶液 | 洗气 |
| A、A | B、B | C、C | D、D |
25℃时,二元酸H2CO3的溶液中离子种类分布如图,H2CO3、HCO3-、CO32-的浓度总和为为0.1mol?L-1,现有一组Na2CO3和NaHCO3混合溶液,下列有关溶液中离子浓度关系的叙述正确的是( )
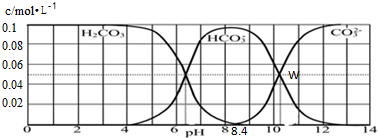

| A、pH=11的溶液中,c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
| B、W点所表示的溶液中:c(Na+)=0.15mol?L-1 |
| C、pH=8.4的溶液中,c(OH-)=c(H+)+c(HCO3-)+2c(CO32-) |
| D、pH=9时,c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) |
下列过程与配合物的形成无关的是( )
| A、向一定量的AgNO3溶液中加入氨水至沉淀消失 |
| B、向FeCl3溶液中加入KSCN溶液 |
| C、向一定量的CuSO4溶液中加入氨水至沉淀消失 |
| D、除去铁粉中的铝粉可以用强碱溶液 |
为确定某溶液的离子组成,进行实验:根据以上实验,以下对原溶液的推测正确的是( )
①测定溶液的pH值,溶液显碱性;
②取少量溶液加稀盐酸至溶液呈酸性,产生能使澄清石灰水变浑浊的气体;
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀;
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀.
①测定溶液的pH值,溶液显碱性;
②取少量溶液加稀盐酸至溶液呈酸性,产生能使澄清石灰水变浑浊的气体;
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀;
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀.
| A、一定有CO32-离子存在 |
| B、不能确定是否存在HCO3-离子存在 |
| C、一定有C1-离子存在 |
| D、一定有SO32-离子存在 |
下列说法正确的是( )
| A、HR溶液的导电性较弱,所以HR属于弱酸 |
| B、某化合物溶于水导电,该化合物一定是电解质 |
| C、NaCl是电解质,食盐的水溶液也是电解质 |
| D、根据电解质在水溶液中的电离程度,将电解质分为强电解质和弱电解质 |