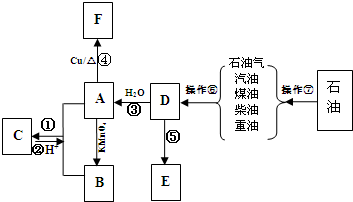
题目内容
 已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol/L CH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )
已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol/L CH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )| A、c点表示CH3COOH和NaOH恰好反应完全 | ||
| B、b点表示的溶液中c(CH3COO-)>c(Na+) | ||
| C、a点表示溶液中c(CH3COO-)约为10-3mol/L | ||
D、b、d点表示的溶液中
|
考点:中和滴定
专题:电离平衡与溶液的pH专题
分析:A.CH3COOH和NaOH恰好反应完全生成醋酸钠,溶液的pH>7;
B.b点溶液显酸性,由电荷守恒分析;
C.a点pH=3,由CH3COOH?CH3COO-+H+分析;
D.b、d 点温度不变,则K不变.
B.b点溶液显酸性,由电荷守恒分析;
C.a点pH=3,由CH3COOH?CH3COO-+H+分析;
D.b、d 点温度不变,则K不变.
解答:
解:A.CH3COOH和NaOH恰好反应完全生成醋酸钠,溶液的pH>7,而c点溶液的pH=7,应醋酸剩余,故A错误;
B.b点溶液显酸性,c(H+)>c(OH-),由电荷守恒可知,c(Na+)<c(CH3COO-),故B正确;
C.a点pH=3,由CH3COOH?CH3COO-+H+可知,c(H+)=c(CH3COO-)=10-3mol/L,故C正确;
D.CH3COOH的电离平衡常数为K=
,b、d 点温度不变,则K不变,故D正确;
故选A.
B.b点溶液显酸性,c(H+)>c(OH-),由电荷守恒可知,c(Na+)<c(CH3COO-),故B正确;
C.a点pH=3,由CH3COOH?CH3COO-+H+可知,c(H+)=c(CH3COO-)=10-3mol/L,故C正确;
D.CH3COOH的电离平衡常数为K=
| c(CH3COO-)?c(H+) |
| c(CH3COOH) |
故选A.
点评:本题考查酸碱混合溶液的定性判断,明确图象中各点的pH及溶液中的溶质即可解答,注意电荷守恒及电离平衡常数只与温度有关,题目难度不大.

练习册系列答案
相关题目
实验室有下列试剂,其中必须用带橡胶塞的玻璃试剂瓶保存的是( )
①NaOH溶液 ②水玻璃 ③Na2S溶液 ④Na2CO3溶液 ⑤NH4Cl溶液 ⑥澄清石灰水.
①NaOH溶液 ②水玻璃 ③Na2S溶液 ④Na2CO3溶液 ⑤NH4Cl溶液 ⑥澄清石灰水.
| A、①和⑥ | B、①②③④和⑥ |
| C、①②③和⑥ | D、①②③和④ |
为鉴别某白色纺织物的成分是蚕丝还是人造丝,通常选用的方法是( )
| A、滴加醋酸 | B、滴加浓硫酸 |
| C、滴加酒精 | D、火焰上灼烧 |
25℃时,二元酸H2CO3的溶液中离子种类分布如图,H2CO3、HCO3-、CO32-的浓度总和为为0.1mol?L-1,现有一组Na2CO3和NaHCO3混合溶液,下列有关溶液中离子浓度关系的叙述正确的是( )
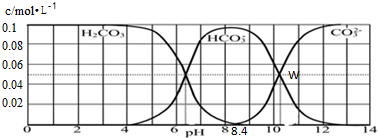

| A、pH=11的溶液中,c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
| B、W点所表示的溶液中:c(Na+)=0.15mol?L-1 |
| C、pH=8.4的溶液中,c(OH-)=c(H+)+c(HCO3-)+2c(CO32-) |
| D、pH=9时,c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) |
配制一定体积、一定物质的量浓度的溶液时,下列操作会使配得的溶液浓度偏小的是( )
| A、容量瓶中原有少量蒸馏水 |
| B、定容时观察液面仰视 |
| C、定容时观察液面俯视 |
| D、胶头滴管加水定容时,有少量水滴到容量瓶外 |
25℃时,pH=5的NH4Cl溶液中,由水电离出的OH-浓度是( )
| A、1×10-5mol/L |
| B、1×10-7mol/L |
| C、1×10-9mol/L |
| D、1×10-14mol/L |