题目内容
 氮族元素包括N、P、As、Sb和Bi五种元素.
氮族元素包括N、P、As、Sb和Bi五种元素.(1)下列关于氮族元素的说法正确的是
a.N2可用于填充霓虹灯.其发光原理是电子从能量较低的轨道跃迁到能量较高的轨道,以光的形式释放能量
b.P、Na、S三种元素的第一电离能由大到小的顺序是:P>S>Na
c.基态As原子中,电子占据的最高能级为4d
d.Bi原子中最外层有5个能量相同的电子
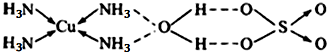
(2)NH3在水中的溶解度比PH3大得多,其原因是
(3)PCl3分子中,Cl-P-Cl键的键角
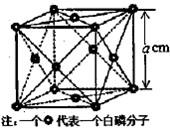
(4)白磷(P4)是磷的一种单质,它属于分子晶体,其晶胞结构如图.己知该晶体的密度为ρ g?cm-3,晶胞的边长为a cm,则阿伏加德罗常数为
考点:晶胞的计算,元素周期律的作用,配合物的成键情况
专题:化学键与晶体结构
分析:(1)a、根据能量守恒和电子能级跃迁原理,只有当电子从能量较高的轨道跃迁到能量较低的轨道,才能以光的形式释放能量,据此判断;
b、根据元素周期律可比较第一电离能;
c、基态As原子的核外电子排布式为1s22s22p63s23p63d104s24p3,据此作判断;
d、Bi原子为第ⅤA族第六周期,它的最外层的电子排布为:6s26p3,5个电子的能量不完全相同,据此判断;
(2)根据氨分子与水分子之间可以形成氢键可知氨气易溶于水的原因;[Cu(NH3)4]SO4为配合物,根据配合物的结构特点可知里面存在的化学键;
(3)PCl3分子中除了有三个P-Cl键外还有一对孤电子对,根据价层电子对互斥理论可知,Cl-P-Cl键的键角与109°28′的大小;
(4)因为在每个晶胞中包含白磷(P4)的分子数为8×
+6×
=4,根据密度公式ρ=
,可求得阿伏加德罗常数.
b、根据元素周期律可比较第一电离能;
c、基态As原子的核外电子排布式为1s22s22p63s23p63d104s24p3,据此作判断;
d、Bi原子为第ⅤA族第六周期,它的最外层的电子排布为:6s26p3,5个电子的能量不完全相同,据此判断;
(2)根据氨分子与水分子之间可以形成氢键可知氨气易溶于水的原因;[Cu(NH3)4]SO4为配合物,根据配合物的结构特点可知里面存在的化学键;
(3)PCl3分子中除了有三个P-Cl键外还有一对孤电子对,根据价层电子对互斥理论可知,Cl-P-Cl键的键角与109°28′的大小;
(4)因为在每个晶胞中包含白磷(P4)的分子数为8×
| 1 |
| 8 |
| 1 |
| 2 |
| ||
| a3 |
解答:
解:(1)a、根据能量守恒和电子能级跃迁原理,只有当电子从能量较高的轨道跃迁到能量较低的轨道,才能以光的形式释放能量,故a错误;
b、根据元素周期律,P、Na、S三种元素位于同一周期,但P最外层处于半充满状态,故按Na、S、P的顺序第一电离能依次增大,故b正确;
c、基态As原子的核外电子排布式为1s22s22p63s23p63d104s24p3,电子占据的最高能级为4p,故c错误;
d、Bi原子为第ⅤA族第六周期,它的最外层的电子排布为:6s26p3,5个电子的能量不完全相同,故d错误;
故答案为:b;
(2)根据氨分子与水分子之间可以形成氢键可知氨气易溶于水的原因;[Cu(NH3)4]SO4为配合物,根据配合物的结构特点可知里面氨分子与铜离子之间存在配位键,硫酸根与铜氨配离子之间是离子键,
故答案为:氨分子与水分子之间可以形成氢键;离子键;配位键;
(3)PCl3分子中除了有三个P-Cl键外还有一对孤电子对,根据价层电子对互斥理论可知,孤电子对与共价键之间的斥力大于共价键与共价键之间的斥力,所以Cl-P-Cl键的键角小于109°28′,故答案为:<;
(4)因为在每个晶胞中包含白磷(P4)的分子数为8×
+6×
=4,根据密度公式ρ=
,可得NA=
=
,故答案为:
.
b、根据元素周期律,P、Na、S三种元素位于同一周期,但P最外层处于半充满状态,故按Na、S、P的顺序第一电离能依次增大,故b正确;
c、基态As原子的核外电子排布式为1s22s22p63s23p63d104s24p3,电子占据的最高能级为4p,故c错误;
d、Bi原子为第ⅤA族第六周期,它的最外层的电子排布为:6s26p3,5个电子的能量不完全相同,故d错误;
故答案为:b;
(2)根据氨分子与水分子之间可以形成氢键可知氨气易溶于水的原因;[Cu(NH3)4]SO4为配合物,根据配合物的结构特点可知里面氨分子与铜离子之间存在配位键,硫酸根与铜氨配离子之间是离子键,
故答案为:氨分子与水分子之间可以形成氢键;离子键;配位键;
(3)PCl3分子中除了有三个P-Cl键外还有一对孤电子对,根据价层电子对互斥理论可知,孤电子对与共价键之间的斥力大于共价键与共价键之间的斥力,所以Cl-P-Cl键的键角小于109°28′,故答案为:<;
(4)因为在每个晶胞中包含白磷(P4)的分子数为8×
| 1 |
| 8 |
| 1 |
| 2 |
| ||
| a3 |
| 4×31×4 |
| ρa3 |
| 496 |
| ρa3 |
| 496 |
| ρa3 |
点评:本题考查了元素周期律、分子结构、微粒间的作用力、及晶胞的计算等知识,中等难度,注重了基础知识的考查.

练习册系列答案
相关题目
某有机物的结构简式如图,该有机物不可能具有的性质是( )


| A、能与溴水发生氧化反应,使溴水褪色 |
| B、能使酸性KMnO4溶液褪色 |
| C、能发生聚合反应 |
| D、能发生酯化反应 |
下列有关化学用语的表述正确的是( )
A、乙烯的球棍模型: |
B、 命名:2-甲基-二丁烯 命名:2-甲基-二丁烯 |
C、过氧化氢的电子式: |
| D、二氧化碳的结构式:O=C=O |
下列有关实验操作、实验结论和说法正确的是( )
| A、将滴定管洗净,再用蒸馏水润洗后,即可注入标准液进行滴定 |
| B、粗略配制浓度为2mol?L-1的NaCl溶液,可将58.5g NaCl加入到盛有500mL水的烧杯中,搅拌、溶解 |
| C、向乙酸乙酯中加入稀NaOH溶液,振荡,分液,可除去乙酸乙酯中的少量乙酸 |
| D、为验证氯仿中含有的氯元素,可向氯仿中加入NaOH溶液,加热充分反应后,再加入AgNO3,观察到白色沉淀 |
 金属及其化合物在生活、科研、生产中有着重要的作用.
金属及其化合物在生活、科研、生产中有着重要的作用.