题目内容
 金属及其化合物在生活、科研、生产中有着重要的作用.
金属及其化合物在生活、科研、生产中有着重要的作用.(1)皮肤粘上高锰酸钾形成的黑斑很久才能消除,如果用H2C2O4(乙二酸为二元弱酸)的稀溶液洗涤,黑斑可以迅速褪去,写出该反应的离子方程式
(2)如图为某蓄电系统的示意图.反应原理为:2Na2S2+NaBr3
| 放电 |
| 充电 |
(3)某工业生产中,向含有大量Ca2+、Mn2+的溶液中加入足量NH4HCO3,生成MnCO3沉淀和CO2,写出该反应的离子方程式
| c(Ca2+) |
| c(Mn2+) |
[已知Ksp(MnCO3)=1×10-11(mol?L-1)2,Ksp(CaCO3)=5×10-9(mol?L-1)2].
考点:化学电源新型电池,难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题,电化学专题
分析:(1)高锰酸钾具有氧化性,能将草酸氧化为二氧化碳,本身被还原为锰离子;
(2)根据电池充、放电的化学反应方程式为2Na2S2+NaBr3
Na2S4+3NaBr可知,负极反应为2Na2S2-2e-=2Na++Na2S4,正极反应为NaBr3+2Na++2e-=3NaBr,根据电解硫酸铜的原理:第一阶段:2CuSO4+2H2O
2Cu↓+O2↑+2H2SO4,第二阶段:2H2O
2H2↑+O2↑,根据所加入的 Cu2 (OH)2CO3的量根据电极反应来计算即可;
(3)依据原子守恒结合反应特征分子推断反应产物,根据沉淀溶解平衡常数的关系进行计算.
(2)根据电池充、放电的化学反应方程式为2Na2S2+NaBr3
| 放电 |
| 充电 |
| ||
| ||
(3)依据原子守恒结合反应特征分子推断反应产物,根据沉淀溶解平衡常数的关系进行计算.
解答:
解:(1)高锰酸钾具有氧化性,能将草酸氧化为二氧化碳,本身被还原为锰离子,该反应的离子方程式为:2MnO4-+5H2C2O4+6H+=10CO2+2Mn2++8H2O,
故答案为:2MnO4-+5H2C2O4+6H+=10CO2+2Mn2++8H2O;
(2)闭合K时,a为原电池的负极,负极发生氧化反应,b为正极,发生还原反应,电极反应为:Br3-+2e-=3Br-,电解质中的钠离子从负极流向正极,即从a到b;
电解硫酸铜时,阳极上是氢氧根离子失电子的过程:4OH--4e-=O2↑+2H2O,初阶段:2CuSO4+2H2O
2Cu↓+O2↑+2H2SO4,后阶段:2H2O
2H2↑+O2↑,如果只按照第一阶段的电解,反应只需要加入CuO或CuCO3就可以,但是现在加入的是Cu2(OH)2CO3,相当于多加入了0.1molCuO和0.1molH2O,这0.1mol的水,应该是第二阶段的反应进行,该阶段转移了0.4mol电子,第一阶段转移了0.2mol电子,所以总共转移电子0.6mol,个数为0.6NA,
故答案为:a;b;Br3-+2e-=3Br-;4OH--4e-=O2↑+2H2O;0.6NA;
(3)锰离子和碳酸氢根离子之间可以发生双水解反应,即Mn2++2HCO3-=MnCO3↓+H2O+CO2↑,Ksp(MnCO3)=c(Mn2+)?c(CO32-)=1×10-11(mol?L-1)2,Ksp(CaCO3)=c(Ca2+)?c(CO32-)=5×10-9(mol?L-1)2,两式子相除,得到:剩余溶液中
<500,故答案为:Mn2++2HCO3-=MnCO3↓+H2O+CO2↑;500.
故答案为:2MnO4-+5H2C2O4+6H+=10CO2+2Mn2++8H2O;
(2)闭合K时,a为原电池的负极,负极发生氧化反应,b为正极,发生还原反应,电极反应为:Br3-+2e-=3Br-,电解质中的钠离子从负极流向正极,即从a到b;
电解硫酸铜时,阳极上是氢氧根离子失电子的过程:4OH--4e-=O2↑+2H2O,初阶段:2CuSO4+2H2O
| ||
| ||
故答案为:a;b;Br3-+2e-=3Br-;4OH--4e-=O2↑+2H2O;0.6NA;
(3)锰离子和碳酸氢根离子之间可以发生双水解反应,即Mn2++2HCO3-=MnCO3↓+H2O+CO2↑,Ksp(MnCO3)=c(Mn2+)?c(CO32-)=1×10-11(mol?L-1)2,Ksp(CaCO3)=c(Ca2+)?c(CO32-)=5×10-9(mol?L-1)2,两式子相除,得到:剩余溶液中
| c(Ca2+) |
| c(Mn2+) |
点评:本题涉及电解池、原电池的工作原理以及沉淀的转化和沉淀溶解平衡常数的计算等知识,属于综合知识的考查,难度大.

练习册系列答案
相关题目
 如图为阳离子交换膜法电解饱和食盐水原理示意图.下列说法不正确的是( )
如图为阳离子交换膜法电解饱和食盐水原理示意图.下列说法不正确的是( )| A、从D口逸出的气体是H2 |
| B、从B口加入稀NaOH(增强导电性)的水溶液 |
| C、每生成22.4L Cl2,同时产生2mol NaOH |
| D、从A口加入精制的浓食盐水 |
分子式为C8H10芳香烃苯环上的一卤代物数目为( )
| A、9种 | B、8种 | C、10种 | D、6种 |
下列说法正确的是( )
| A、常温下可用铝制容器贮藏运输浓硫酸 |
| B、石英容器可盛放任何酸 |
| C、二氧化氯具有还原性,可用于自来水的杀菌消毒 |
| D、在海轮外壳上装若干铜块可减缓钢铁腐蚀 |
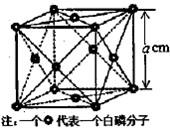 氮族元素包括N、P、As、Sb和Bi五种元素.
氮族元素包括N、P、As、Sb和Bi五种元素.
 磁性材料氮化铁镍合金可用Fe(NO3)3、Ni(NO3)2、丁二酮肟、氨气、氮气、氢氧化钠、盐酸等物质在一定条件下反应制得.
磁性材料氮化铁镍合金可用Fe(NO3)3、Ni(NO3)2、丁二酮肟、氨气、氮气、氢氧化钠、盐酸等物质在一定条件下反应制得.