题目内容
14.下列溶液中氯离子的物质的量浓度最大的是( )| A. | 65 mL 2mol/L的NaCl溶液 | B. | 25 mL 2mol/L的MgCl2溶液 | ||
| C. | 10 mL 2mol/L的AlCl3溶液 | D. | 50 mL 2mol/L的kCl溶液 |
分析 利用物质的构成及溶质的物质的量浓度来计算氯离子的浓度,氯离子浓度与溶液的体积无关,溶液中c(Cl-)=溶质的物质的量浓度×化学式中氯离子个数,以此来解答.
解答 解:A.65 mL 2mol/L的NaCl溶液溶液中Cl-离子的物质的量浓度为2mol/L×1=2mol/L;
B.25 mL 2mol/L的MgCl2溶液中Cl-离子的物质的量浓度为:2mol/L×2=4mol/L;
C.10 mL 2mol/L的AlCl3溶液中Cl-离子的物质的量浓度为:2mol/L×3=6mol/L;
D.50mL 2mol/L的KCl溶液中Cl-离子的物质的量浓度为:2mol/L×1=2mol/L,
根据分析可知,Cl-离子的物质的量浓度最大的为C,
故选C.
点评 本题考查物质的量浓度的有关计算,题目难度不大,明确离子浓度与溶质的物质的量浓度的关系即可解答,注意掌握物质的量浓度的概念及表达式,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
4.X、Y、Z、M为原子序数依次增大的4种短周期元素.已知X、Y、Z是同周期的相邻元素,M原子的核外电子数是Z原子最外层电子数的2倍,Y与其同主族的短周期元素可形成一种常见的气体.下列说法正确的是( )
| A. | 原子半径:M>Y | B. | 对应氢化物的沸点:M>Z | ||
| C. | 对应氢化物的稳定性:X>Y | D. | XY2与MY2溶于水都能得到对应的酸 |
5.下列离子方程式书写正确的是( )
| A. | 铜和稀硝酸反应 Cu+4H++NO3-=Cu2++2H2O+NO↑ | |
| B. | 碳酸氢钠的水解 HCO3-+H2O=H2CO3+OH- | |
| C. | Fe投入盐酸中 2Fe+6H+=2Fe3++3H2↑ | |
| D. | 氢氧化铝溶于氢氧化钠溶液 Al(OH)3+OH-=AlO2-+2H2O |
2.下列几种铁板,在镀层被破坏后,最耐腐蚀的是( )
| A. | 镀锌铁板 | B. | 镀铜铁板 | C. | 镀锡铁板 | D. | 镀铅铁板 |
9.下列叙述正确的是( )
| A. | 1mol Cl2中约含有6.02×1023个氯原子 | |
| B. | 1mol OH-的质量为17g | |
| C. | 1mol O2的体积约为22.4L | |
| D. | 1mol氢中含有2mol 电子 |
3.某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(标准状况下),实验记录如下(累计值):
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5min)反应速率最大2~3min.
(2)2~3分钟时间段以盐酸的浓度变化来表示的该反应速率0.1mol/(L•min).(设溶液体积不变)
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:
A.蒸馏水、B.NaCl溶液、C.NaNO3溶液 D.CuSO4溶液 E.Na2CO3溶液,你认为可行的是AB.
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(2)2~3分钟时间段以盐酸的浓度变化来表示的该反应速率0.1mol/(L•min).(设溶液体积不变)
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:
A.蒸馏水、B.NaCl溶液、C.NaNO3溶液 D.CuSO4溶液 E.Na2CO3溶液,你认为可行的是AB.
4.将500mL NH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含a mol NaOH的溶液恰好反应完全;另取一份加入含b mol HCl的盐酸恰好反应完全,则该化合物溶液中c(Na+)为( )
| A. | ($\frac{b}{10}$-$\frac{a}{20}$) mol•L-1 | B. | (2b-a) mol•L-1 | C. | (5b-$\frac{5a}{2}$) mol•L-1 | D. | (10b-5a) mol•L-1 |
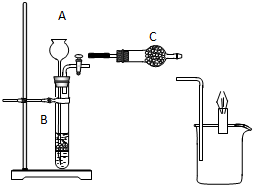 如图所示装置中,已知B中隔板上放的是石灰石,若当打开活塞时,烧杯中的蜡烛燃烧得更旺,请回答:
如图所示装置中,已知B中隔板上放的是石灰石,若当打开活塞时,烧杯中的蜡烛燃烧得更旺,请回答: