题目内容
12.在标准状况下,200mL某气体的质量是0.358g,该种气体的相对分子质量.分析 先根据n=$\frac{V}{{V}_{m}}$计算出该气体的物质的量,再结构M=$\frac{m}{n}$计算出其摩尔质量,最后利用摩尔质量与相对分子质量的关系来解答.
解答 解:200mL该气体在标准状况下的物质的量为:$\frac{0.2L}{22.4L/mol}$=$\frac{1}{112}$mol,
该气体的摩尔质量为:M=$\frac{0.358g}{\frac{1}{112}mol}$≈40,
摩尔质量与g/mol为单位时在数值上与相对分子质量相等,所以该气体的相对分子质量为40,
答:该气体的相对分子质量为40.
点评 本题考查了物质的量的计算,题目难度不大,明确摩尔质量与相对分子质量之间的关系为解答关键,注意掌握物质的量与摩尔质量、气体摩尔体积之间的关系,试题培养了学生的化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.下列有关表达不正确的是( )
| A. | 符号为${\;}_8^{18}$O的原子常用于文物年代的测定 | |
| B. | 原子结构示意图 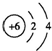 既可以表示12C,也可以表示14C 既可以表示12C,也可以表示14C | |
| C. | 具有16个质子、16个中子和18个电子的微粒是${\;}_{16}^{32}$S2- | |
| D. | “84消毒液”中有效成分NaClO的电子式为  |
7.把一定浓度的NaOH溶液分成两等份,一份密闭保存,另一份敞口放置,几天后分别与相同浓度的盐酸反应,都恰好完全反应时,若第一份用去盐酸V1mL,第二份用去盐酸V2mL,则两者的关系为( )
| A. | V1=V2 | B. | V1>V2 | C. | V1<V2 | D. | 不能确定 |
17.下列属于非极性分子的是( )
| A. | H2O2 | B. | CH3Cl | C. | SO3 | D. | NH3 |
18.下列实验现象与对应化学方程式都正确的是( )
| A. | 金属钠投入水中,浮在水面熔成小球,并在水面快速移动,得到的溶液显碱性;2 Na+2 H2O═2 NaOH+H2↑ | |
| B. | 氢气在氯气中安静的燃烧,发出淡蓝色火焰,瓶口出现白雾;H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl | |
| C. | FeSO4溶液中加入NaOH溶液时,生成的白色絮状沉淀迅速变为灰绿色,最后变成红褐色; 2Fe(OH)2+O2+H2O═2 Fe(OH)3 | |
| D. | 向Na2SiO3溶液中逐滴加入稀盐酸,边加边振荡,有透明的硅酸凝胶产生;Na2SiO3+2HCl═H2SiO3(胶体)+2NaCl |

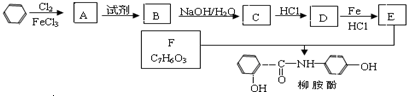
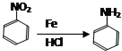
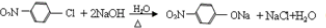 .
.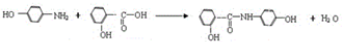 .
. .
.