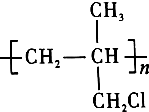题目内容
4.用足量的CO还原32.0g铁的某种氧化物,将生成的气体通入足量澄清石灰水中,得到60g沉淀,试计算确定该铁的氧化物的化学式.分析 先根据生成的气体通入足量澄清石灰水中得到60g沉淀求出二氧化碳的物质的量,再计算出金属氧化物中氧元素的质量,然后利用金属氧化物的质量来计算金属元素与氧元素的质量比,然后计算出其物质的量之比即可.
解答 解:由题意知60g沉淀为碳酸钙的质量,
则碳酸钙的物质的量为$\frac{60g}{100g/mol}$=0.6mol,
由CO还原32.0g铁的氧化物,将生成的气体通入足量澄清石灰水中得到沉淀,
设铁的氧化物中氧元素的物质的量为x,
根据碳元素守恒可知CO~O~CO2~CaCO3,
1 1
x 0.6mol
则:x=0.6mol,
则32.0g氧化物中Fe元素的质量为:32.0g-16g/mol×0.6mol=22.4g,该氧化物中含有铁的物质的量为$\frac{22.4g}{56g/mol}$=0.4mol,
所以该铁的氧化物中Fe与O的物质的量之比=0.4mol:0.6mol=2:3,该氧化物的化学式为Fe2O3,
答:该铁的氧化物的化学式Fe2O3.
点评 本题考查氧化还原反应的计算,题目难度中等,明确反应中元素的守恒来分析金属氧化物中氧元素的质量是解答的关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.用高氯酸、硫酸、氢碘酸、醋酸、钠盐、钾盐、铵盐、钡盐相互反应,符合离子方程式2H++CO32-═CO2↑+H2O的反应有( )
| A. | 6个 | B. | 8个 | C. | 9个 | D. | 12个 |
15.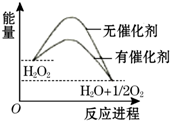 已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示.下列说法正确的是( )
已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示.下列说法正确的是( )
 已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示.下列说法正确的是( )
已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示.下列说法正确的是( )| A. | 加入催化剂,减小了反应的热效应 | |
| B. | 加入催化剂,可提高H2O2的平衡转化率 | |
| C. | H2O2分解的热效应△H<0 | |
| D. | 反应物的总能量高于生成物的总能量 |
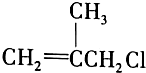 是药品的中间体,属可疑人类致癌物,针对该有机物的描述中,正确的有( )
是药品的中间体,属可疑人类致癌物,针对该有机物的描述中,正确的有( )