题目内容
4.常温下pH=1的乙酸溶液和pH=13的NaOH溶液,下列叙述中正确的是( )| A. | 乙酸溶液中水的电离程度比NaOH溶液中的小 | |
| B. | 乙酸溶液中c(CH3COOH)大于NaOH溶液中c(Na+) | |
| C. | 若两溶液混合后pH=7,则有:c(Na+)=c(CH3COOH)+c(CH3COO-) | |
| D. | 分别稀释10倍,两溶液的pH之和大于14 |
分析 A.酸溶液和碱溶液都抑制了水的电离,盐酸中氢离子与氢氧化钠溶液中氢氧根离子浓度都是0.1mol/L,所以对水的电离的影响相同;
B.醋酸为弱酸,醋酸的浓度远远大于0.1mol/L,氢氧化钠为强电解质,则氢氧化钠的浓度为0.1mol/L;
C.溶液为中性,则c(H+)=c(OH-),根据混合液中的电荷守恒分析;
D.pH=13的氢氧化钠溶液稀释10倍后,溶液的pH=12,醋酸为弱酸,稀释后溶液的pH<2.
解答 解:A.常温下pH=1的乙酸溶液中氢离子浓度为0.1mol/L,pH=13的NaOH溶液中氢氧根离子浓度为0.1mol/L,两溶液都抑制了水的电离,所以两溶液中水的电离程度相等,故A错误;
B.乙酸溶液中氢离子浓度为0.1mol/L,醋酸为弱酸,则醋酸的浓度远远大于0.1mol/L,即c(CH3COOH)>0.1mol/L,而pH=13的NaOH溶液中c(Na+)浓度为0.1mol/L,所以乙酸溶液中c(CH3COOH)大于NaOH溶液中c(Na+),故B正确;
C.若两溶液混合后pH=7,则c(H+)=c(OH-),根据电荷守恒可得:c(Na+)=c(CH3COO-),故C错误;
D.氢氧化钠为强电解质,pH=13的氢氧化钠溶液稀释10倍后,溶液的pH=12,醋酸为弱酸,稀释过程中醋酸的电离程度增大,则稀释后醋酸溶液的pH<2,所以稀释后两溶液的pH之和小于14,故D错误;
故选B.
点评 本题考查了离子浓度大小比较、酸碱混合的定性判断,题目难度中等,注意掌握酸碱混合的定性判断方法,明确电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.下列各组物质的性质比较中,不正确的是( )
| A. | 碱性:NaOH>Mg(OH)2 | B. | 热稳定性:Na2CO3>NaHCO3 | ||
| C. | 金属性:Na>Mg | D. | 水中溶解性:Mg(OH)2>Na2CO3 |
15.下列四组物质,组内每种混合物都能用分液漏斗分离的是( )
| A. | 乙酸乙酯和水、酒精和水、植物油和水 | |
| B. | 四氯化碳和水、溴苯和水、硝基苯和水 | |
| C. | 甘油和水、乙酸和乙醇、乙酸和水 | |
| D. | 水和植物油、己烷和水、苯和水 |
12.食品香精菠萝酯的生产路线(反应条件略去)如下,下列叙述错误的是( )


| A. | 步骤(1)产物中残留的苯酚可用FeCl3溶液检验 | |
| B. | 苯酚和菠萝酯均可与酸性KMnO4溶液发生反应 | |
| C. | 苯酚和菠萝酯均可与溴水发生反应 | |
| D. | 步骤(2)产物中残留的烯丙醇可用溴水检验 |
19.已知2-丁烯有顺、反两种异构体,在某条件下两种气体处于平衡:下列说法正确的是( )
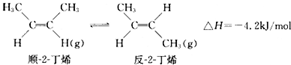

| A. | 顺-2-丁烯比反-2-丁烯稳定 | |
| B. | 顺-2-丁烯的燃烧热数值比反-2-丁烯大 | |
| C. | 加压和降温都有利于平衡向生成顺-2-丁烯反应方向移动 | |
| D. | 反-2-丁烯不能使溴水褪色 |
9.已知下表均为烷烃分子的化学式,且它们的一氯取代物只有一种
则第6项烷烃分子的化学式( )
| 1 | 2 | 3 | 4 | 5 | 6 | … |
| … | C2H6 | C5H12 | C8H18 | … | … | … |
| A. | C16H34 | B. | C17H36 | C. | C26H54 | D. | C27H56 |
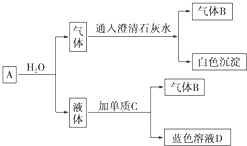
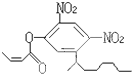 阿乐丹的结构简式可简写为如图,它在稀酸作用下能水解生成两种有机物,这两种有机物可能共同具有的性质是( )
阿乐丹的结构简式可简写为如图,它在稀酸作用下能水解生成两种有机物,这两种有机物可能共同具有的性质是( )