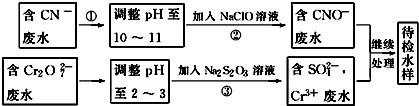
题目内容
14.下列各组物质的性质比较中,不正确的是( )| A. | 碱性:NaOH>Mg(OH)2 | B. | 热稳定性:Na2CO3>NaHCO3 | ||
| C. | 金属性:Na>Mg | D. | 水中溶解性:Mg(OH)2>Na2CO3 |
分析 A.元素的金属性越强,其最高价氧化物的水化物碱性越强;
B.碱金属族碳酸氢盐稳定性小于碳酸盐;
C.同一周期元素,元素的金属性随着原子序数增大而减弱;
D.钠盐都是可溶性物质,氢氧化镁不易溶于水.
解答 解:A.元素的金属性越强,其最高价氧化物的水化物碱性越强,金属性Na>Mg,所以碱性NaOH>Mg(OH)2,故A正确;
B.碱金属族碳酸氢盐稳定性小于碳酸盐,所以稳定性Na2CO3>NaHCO3,故B正确;
C.同一周期元素,元素的金属性随着原子序数增大而减弱,所以金属性Na>Mg,故C正确;
D.钠盐都是可溶性物质,氢氧化镁不易溶于水,碳酸钠易溶于水,所以溶解性Mg(OH)2<Na2CO3,故D错误.
故选D.
点评 本题考查金属性、稳定性、溶解性大小比较,侧重考查元素化合物知识,知道金属性强弱判断方法,熟练掌握元素周期律并灵活运用,题目难度不大.

练习册系列答案
相关题目
12.最新报道的“人工固氮”反应为:2N2(g)+6H2O(l)?4NH3(g)+3O2(g),常压下测得该反应的部分数据如表所示.则关于该反应的说法中不正确的是( )
| T/℃ | 30 | 40 | 50 |
| NH3的平衡浓度/(×10-6mol/L) | 4.8 | 5.9 | 6.0 |
| A. | 该反应的△H>0 | |
| B. | 常温下该反应的△S>0 | |
| C. | 反应在30℃、40℃时化学平衡常数分别为K1、K2,则K1<K2 | |
| D. | 在常温常压下,人工固氮比较容易进行 |
13.与溴水反应不会产生沉淀的是( )
| A. | 乙烯 | B. | AgNO3溶液 | C. | H2S | D. | 苯酚 |
2.要求设计实验证明某种盐的水解是吸热的,有四位学生分别作出如下回答,其中正确的是( )
| A. | 丁学生:在醋酸钠溶液中滴入酚酞溶液,加热后若红色加深,说明盐类水解是吸热的 | |
| B. | 甲学生:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的 | |
| C. | 乙学生:在盐酸中加入同温度的氨水,若混合液温度下降,说明盐类水解是吸热的 | |
| D. | 丙学生:在醋酸钠溶液中加入醋酸钠晶体,若溶液温度下降,说明盐类水解是吸热的 |
9.Murad等三位教授最早提出NO分子在人体内独特功能.近年来此领域研究有很大进展,因此这三位教授荣获1998年诺贝尔医学奖及生理学奖.下列关于NO的叙述不正确的是( )
| A. | NO对环境的危害在于破坏臭氧层、形成酸雨等方面 | |
| B. | NO可以是某些高价N物质的还原产物也可以是某些含低价N物质的氧化产物 | |
| C. | 实验室制取的NO可以用用排水法和向上排空气法收集 | |
| D. | 生物体内存在少量NO能提高其生理机能,如扩张血管、促进免疫力 |
19.某有机物的蒸气,完全燃烧时消耗的氧气体积和生成的二氧化碳体积都是它本身体积的2倍.该有机物可能是( )
①C2H4 ②H2C═C═O(乙烯酮) ③CH3CHO ④CH3COOH.
①C2H4 ②H2C═C═O(乙烯酮) ③CH3CHO ④CH3COOH.
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ③④ |
3.下列物质属于苯的同系物的是( )
①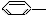 CH3 ②
CH3 ②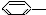 CH=CH2
CH=CH2
③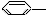 NO2 ④
NO2 ④ OH
OH
⑤ ⑥
⑥ CH-(CH3)2.
CH-(CH3)2.
①
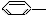 CH3 ②
CH3 ②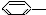 CH=CH2
CH=CH2 ③
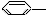 NO2 ④
NO2 ④ OH
OH ⑤
 ⑥
⑥ CH-(CH3)2.
CH-(CH3)2.| A. | ③④ | B. | ②⑤ | C. | ①⑥ | D. | ①②⑤⑥ |
4.常温下pH=1的乙酸溶液和pH=13的NaOH溶液,下列叙述中正确的是( )
| A. | 乙酸溶液中水的电离程度比NaOH溶液中的小 | |
| B. | 乙酸溶液中c(CH3COOH)大于NaOH溶液中c(Na+) | |
| C. | 若两溶液混合后pH=7,则有:c(Na+)=c(CH3COOH)+c(CH3COO-) | |
| D. | 分别稀释10倍,两溶液的pH之和大于14 |