题目内容
14.下列排列顺序正确的是( )①酸性:H3PO4>H2SO4>HClO4
②热稳定性:H2O>HF>H2S
③原子半径:Na>Mg>O
④还原性:S2->Cl->F-
⑤沸点:H2 Se>H2S>H2O.
| A. | ③⑤ | B. | ②③ | C. | ③④ | D. | ②④ |
分析 ①元素的非金属性越强,其最高价氧化物的水化物酸性越强;
②元素的非金属性越强,其氢化物的稳定性越强;
③原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
④电子层数越多离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小;
⑤同一主族元素氢化物的熔沸点随着原子序数增大而增大,但含有氢键的氢化物熔沸点最高.
解答 解:①元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Cl>S>P,所以其最高价含氧酸酸性H3PO4<H2SO4<HClO4,故错误;
②元素的非金属性越强,其氢化物的稳定性越强,非金属性F>O>S,所以氢化物的稳定性HF>H2O>H2S,故错误;
③原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以原子半径Na>Mg>O,故正确;
④电子层数越多离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,所以离子半径S2->Cl->F-,故正确;
⑤同一主族元素氢化物的熔沸点随着原子序数增大而增大,但含有氢键的氢化物熔沸点最高,水中含有氢键,熔沸点最高,则熔沸点H2O>H2Se>H2S,故错误;
故选C.
点评 本题考查非金属性强弱判断、离子半径大小比较等知识点,侧重考查元素周期律,明确同一主族、同一周期元素原子结构及其性质递变规律即可解答,注意氢化物熔沸点中氢键的影响,题目难度不大.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
4.常温下pH=1的乙酸溶液和pH=13的NaOH溶液,下列叙述中正确的是( )
| A. | 乙酸溶液中水的电离程度比NaOH溶液中的小 | |
| B. | 乙酸溶液中c(CH3COOH)大于NaOH溶液中c(Na+) | |
| C. | 若两溶液混合后pH=7,则有:c(Na+)=c(CH3COOH)+c(CH3COO-) | |
| D. | 分别稀释10倍,两溶液的pH之和大于14 |
2.下列粒子属等电子体的是( )
| A. | NO和O2 | B. | CH4和NH4+ | C. | NH2?和H2O2 | D. | HCl和H2O |
19.下列描述正确的是( )
| A. | 硝酸的标签上应标注 和 和 | B. | 硫离子结构示意图: | ||
| C. | HClO的电子式: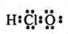 | D. | 239Pu比235U原子核内多4个中子 |
3.下列物质既能发生消去反应生成相应的烯烃,又能氧化生成相应醛的是( )
| A. | CH3OH | B. | CH3CH2CH2OH | C. | 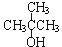 | D. | 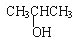 |
4.下列有关核外电子的运动状态的说法中错误的是( )
| A. | 电子亚层(能级)是描述电子运动的电子云状态 | |
| B. | 只有在电子层、电子亚层、电子云的伸展方向及电子的自旋都确定时,电子的运动状态才能确定下来 | |
| C. | 必须在B项所述四个方面都确定时,才能决定组成每一能层的最多轨道数 | |
| D. | 电子云伸展方向与能量大小是无关的 |
 B
B 或
或 C
C E
E
 .
.