题目内容
4.阅读、分析下列两个材料:材料一、

材料二、
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 乙二醇( C2H6O2) | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
| 丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
A.蒸馏法 B.萃取法 C.“溶解、结晶、过滤”的方法 D.分液法
(1)将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用C.
(2)将乙二醇和丙三醇相互分离的最佳方法是A.
(3)回收有机溶剂CCl4时,也需采取蒸馏的方法,下面实验装置图中的错误之处有:
①温度计下端的水银球不能插入溶液中
②冷凝管进出水的方向颠倒
③加热烧杯未垫上石棉网
如图进行上述蒸馏时,使用水溶剂加热的好处是受热均匀,便于控制温度.

分析 (1)由图可知,氯化钠、纯碱的溶解度受温度影响不同;
(2)由表格中数据可知,乙二醇和丙三醇互溶,但沸点不同;
(3)蒸馏是利用物质的沸点不同分离相互溶解的沸点不同的液体,蒸馏时用到蒸馏烧瓶、酒精灯、冷凝管、牛角管、锥形瓶等仪器,注意温度计水银球应处在蒸馏烧瓶的支管口附近,冷凝管应从下口进水,上口出水,以保证水充满冷凝管,起到充分冷凝的作用,为防止溶液爆沸,应加入少量碎瓷片;水浴加热优点:使蒸馏烧瓶受热均匀,便于控制温度.
解答 解:(1)由图可知,氯化钠、纯碱的溶解度受温度影响不同,则将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用“溶解、结晶、过滤”的方法,
故答案为:C;
(2)由表格中数据可知,乙二醇和丙三醇互溶,但沸点不同,则分离的最佳方法是蒸馏法,
故答案为:A;
(3)①蒸馏实验中,温度计测量的是蒸汽的温度所以,温度计下端的水银球不能插入溶液中,温度计的水银球在蒸馏瓶的支管口处;
②为到达最佳冷凝效果,冷凝水应下进上出;
③烧杯加热应垫上石棉网;
因有机溶剂为CCl4(沸点为77℃),低于水的沸点,所以选择水浴加热使蒸馏烧瓶受热均匀,便于控制温度;
故答案为:温度计下端的水银球不能插入溶液中;冷凝管进出水的方向颠倒;加热烧杯未垫上石棉网;受热均匀,便于控制温度.
点评 本题考查混合物分离提纯的实验设计,为高频考点,把握习题中的信息、混合物分离提纯实验、实验操作及技能为解答的关键,侧重分析与实验能力的考查,注意图象及表格数据的应用,题目难度不大.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
14.下列过程中,没有发生化学变化的是( )
| A. | 干冰用于人工降雨 | |
| B. | 蔗糖中加入浓硫酸,蔗糖变黑,体积膨胀 | |
| C. | 溶洞中钟乳石的形成 | |
| D. | 豆科作物的根瘤菌对空气中氮的固定 |
9.表是元素周期表一部分,列出了十个元素在周期表中的位置:
请用化学用语回答下列问题:
(1)在①~⑦元素中,原子半径最大的是K(填元素符号);
(2)①~⑩中元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式),⑤所对应元素的单质工业制备方法为2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.
(3)用电子式表示元素③与⑧形成化合物的过程 .
.
(4)我国首创以单质⑤-空气-海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使单质⑤不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光.则电源的负极反应是4Al-12e-=4Al3+,正极反应为3O2+6H2O+12e-=12OH-.
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑥ | |||||||
| 3 | ① | ③ | ⑤ | ⑦ | ⑧ | ⑩ | ||
| 4 | ② | ④ | ⑨ |
(1)在①~⑦元素中,原子半径最大的是K(填元素符号);
(2)①~⑩中元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式),⑤所对应元素的单质工业制备方法为2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.
(3)用电子式表示元素③与⑧形成化合物的过程
 .
.(4)我国首创以单质⑤-空气-海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使单质⑤不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光.则电源的负极反应是4Al-12e-=4Al3+,正极反应为3O2+6H2O+12e-=12OH-.
16.下表列出了A~R等9种元素在周期表中的位置;
(1)写出下列元素的名称;A钠,C镁,E碳,R氩.
(2)D的原子结构示意图为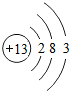 ,其最高价氧化物的水化物与氢氧化钠溶液反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
,其最高价氧化物的水化物与氢氧化钠溶液反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
(3)A、B、C三种元素的原子半径由大到小的顺序为K>Na>Mg(填元素符号),其最高价氧化物对应水化物的碱性由强到弱顺序为KOH>NaOH>Mg(OH)2.(填化学式)
(4)F元素的氢化物的电子式为 ,其中一种氢化物在常温下与MnO2混合的反应化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
,其中一种氢化物在常温下与MnO2混合的反应化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(5)用电子式表示A与H形成化合物的过程为 ,高温灼伤该化合物时,火焰呈黄色.
,高温灼伤该化合物时,火焰呈黄色.
| IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
(2)D的原子结构示意图为
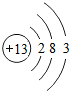 ,其最高价氧化物的水化物与氢氧化钠溶液反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
,其最高价氧化物的水化物与氢氧化钠溶液反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.(3)A、B、C三种元素的原子半径由大到小的顺序为K>Na>Mg(填元素符号),其最高价氧化物对应水化物的碱性由强到弱顺序为KOH>NaOH>Mg(OH)2.(填化学式)
(4)F元素的氢化物的电子式为
 ,其中一种氢化物在常温下与MnO2混合的反应化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
,其中一种氢化物在常温下与MnO2混合的反应化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.(5)用电子式表示A与H形成化合物的过程为
 ,高温灼伤该化合物时,火焰呈黄色.
,高温灼伤该化合物时,火焰呈黄色.
13.煤是工业的粮食,石油是工业的血液.下列关于煤和石油的说法中错误的是( )
| A. | 石油裂解主要目的是得到短链的不饱和烃 | |
| B. | 煤中含有苯和甲苯,可用先干馏后分馏的方法将它们分离出来 | |
| C. | 煤的气化与液化都是化学变化 | |
| D. | 含C18以上烷烃的重油经过催化裂化可以得到汽油 |

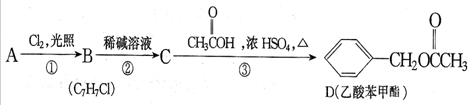
 .
.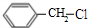 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$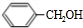 +NaCl.
+NaCl.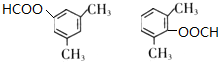 .
.