题目内容
有机反应中常用镍作催化剂.某化工厂收集的镍催化剂中含Ni 64.0%、Al 24.3%、Fe 1.4%,其余为SiO2和有机物.这些含镍废催化剂经乙醇洗涤后可按如图1工艺流程回收镍:
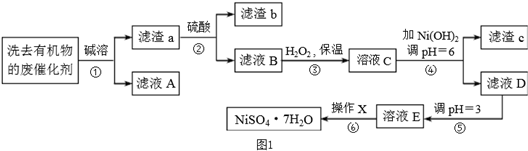
已知:部分阳离子以氢氧化物形式完全沉淀时的pH如下:请回答下列问题:
(1)滤液A中存在的阴离子主要是 .
(2)硫酸浸取滤渣a后,所得滤液B中可能含有的金属离子是 .
(3)滤液B中加入H2O2的目的是 .操作X的名称是 .
(4)含镍金属氢化物MH-Ni燃料电池是一种绿色环保电池,广泛应用于电动汽车,其中M代表储氢合金,MH代表金属氢化物,电解质溶液可以是KOH水溶液.它的充、放电反应为:xNi(OH)2+M
MHx+xNiOOH;电池充电过程中阳极的电极反应式为 ,放电时负极的电极反应式为 .
(5)一种储氢合金M 是由金属镧(La)与镍形成的合金,其晶胞结构如图所示,晶胞中心有一个Ni原子,其他Ni原子,都在晶胞面上,该晶体的化学式为 .
(6)上述回收镍的过程中,使用akg含镍废催化剂,调pH=6时bkg Ni(OH)2,回收过程中,第①~②步操作镍的损失率为5%,第④~⑥步骤的损失率为3%,则最终得到硫酸镍晶体(M=281kg/mol)的质量为 kg(填计算式).

已知:部分阳离子以氢氧化物形式完全沉淀时的pH如下:请回答下列问题:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
(2)硫酸浸取滤渣a后,所得滤液B中可能含有的金属离子是
(3)滤液B中加入H2O2的目的是
(4)含镍金属氢化物MH-Ni燃料电池是一种绿色环保电池,广泛应用于电动汽车,其中M代表储氢合金,MH代表金属氢化物,电解质溶液可以是KOH水溶液.它的充、放电反应为:xNi(OH)2+M
| 充电 |
| 放电 |
(5)一种储氢合金M 是由金属镧(La)与镍形成的合金,其晶胞结构如图所示,晶胞中心有一个Ni原子,其他Ni原子,都在晶胞面上,该晶体的化学式为

(6)上述回收镍的过程中,使用akg含镍废催化剂,调pH=6时bkg Ni(OH)2,回收过程中,第①~②步操作镍的损失率为5%,第④~⑥步骤的损失率为3%,则最终得到硫酸镍晶体(M=281kg/mol)的质量为
考点:原电池和电解池的工作原理,物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:Al与SiO2和碱液反应分别生成偏铝酸钠和硅酸钠留在溶液A中,其余为滤渣进入滤渣a,滤渣a中加入硫酸,金属Fe变为亚铁离子,Ni变为镍离子,加入双氧水的目的是把亚铁离子氧化为铁离子,以便与调节pH使其生成沉淀除去,即溶液C中含有铁离子、镍离子等,调节pH=6,得到沉淀为氢氧化铁,得到溶液为含有镍离子的溶液,然后继续调节pH值,蒸发结晶即可得到目标产物,据此解答各小题即可;电解池中阳极失去电子,发生氧化反应,为充电过程,原电池中负极失去电子,发生氧化反应;依据分摊法计算晶胞中原子个数即可;依据产率计算最后一个空.
解答:
解:Al与SiO2和碱液反应分别生成偏铝酸钠和硅酸钠留在溶液A中,其余为滤渣进入滤渣a,滤渣a中加入硫酸,金属Fe变为亚铁离子,Ni变为镍离子,加入双氧水的目的是把亚铁离子氧化为铁离子,以便与调节pH使其生成沉淀除去,即溶液C中含有铁离子、镍离子等,调节pH=6,得到沉淀为氢氧化铁,得到溶液为含有镍离子的溶液,然后继续调节pH值,蒸发结晶即可得到目标产物,
(1)依据分析可知,滤液A中存在的阴离子主要是AlO2-、SiO32-、OH-,故答案为:AlO2-、SiO32-、OH-;
(2)依据分析可知滤液B中可能含有的金属离子是:Fe3+、Fe2+、Ni2+,故答案为:Fe3+、Fe2+、Ni2+;
(3)加入双氧水的目的是:将Fe3+氧化为Fe2+、有利于分离,操作X为蒸发结晶,故答案为:将Fe3+氧化为Fe2+、有利于分离;蒸发结晶;
(4)阳极失去电子,发生氧化反应,是充电过程,故阳极电极反应方程式为:Ni(OH)2+OH-+e-=NiOOH+H2O;放电为原电池,负极失去电子,发生氧化反应,电极反应方程式为:MHx+xOH--xe-=M++xH2O,故答案为:Ni(OH)2+OH-+e-=NiOOH+H2O;MHx+xOH--xe-=M++xH2O;
(5)该合金的晶胞如图所示,晶胞中心有一个镍原子,其他8个镍原子都在晶胞面上,镧原子都在晶胞顶点,所以晶胞实际含有的镍原子为1+8×
=5,晶胞实际含有的镧原子为8×
=1,所以晶体的化学式Ni5La,
故答案为:Ni5La;
(6)依据题意:调pH=6时bkg Ni(OH)2,回收过程中,第①~②步操作镍的损失率为5%,第④~⑥步骤的损失率为3%,故此计算式为:
×(64%a×95%+
b)×97%,
故答案为:
×(64%a×95%+
b)×97%.
(1)依据分析可知,滤液A中存在的阴离子主要是AlO2-、SiO32-、OH-,故答案为:AlO2-、SiO32-、OH-;
(2)依据分析可知滤液B中可能含有的金属离子是:Fe3+、Fe2+、Ni2+,故答案为:Fe3+、Fe2+、Ni2+;
(3)加入双氧水的目的是:将Fe3+氧化为Fe2+、有利于分离,操作X为蒸发结晶,故答案为:将Fe3+氧化为Fe2+、有利于分离;蒸发结晶;
(4)阳极失去电子,发生氧化反应,是充电过程,故阳极电极反应方程式为:Ni(OH)2+OH-+e-=NiOOH+H2O;放电为原电池,负极失去电子,发生氧化反应,电极反应方程式为:MHx+xOH--xe-=M++xH2O,故答案为:Ni(OH)2+OH-+e-=NiOOH+H2O;MHx+xOH--xe-=M++xH2O;
(5)该合金的晶胞如图所示,晶胞中心有一个镍原子,其他8个镍原子都在晶胞面上,镧原子都在晶胞顶点,所以晶胞实际含有的镍原子为1+8×
| 1 |
| 2 |
| 1 |
| 8 |
故答案为:Ni5La;
(6)依据题意:调pH=6时bkg Ni(OH)2,回收过程中,第①~②步操作镍的损失率为5%,第④~⑥步骤的损失率为3%,故此计算式为:
| 281 |
| 59 |
| 59 |
| 93 |
故答案为:
| 281 |
| 59 |
| 59 |
| 93 |
点评:本题主要考查的是流程,难度较大,设计原电池与电解池原理、晶胞计算、氧化还原反应等,注意总结.

练习册系列答案
相关题目
某溶液中加入铝粉能产生氢气,在该溶液中一定能大量共存的离子组是( )
| A、K+、NH4+、Cl-、SO42- |
| B、Cu2+、Fe2+、NO3-、SO42- |
| C、Na+、Ca2+、Cl-、ClO- |
| D、Na+、K+、Cl-、SO42- |
在2L密闭容器中放入CO(g)、H2O(g)各1mol,发生CO(g)+H2O(g)?CO2(g)+H2(g)△H>0的反应.改变下列条件,不能使v正增大的是( )
| A、升高温度 |
| B、降低温度 |
| C、使用催化剂 |
| D、压缩容器,使其体积变为1 L |
已知X、Y、Z、W是原子序数依次增大的短周期主族元素,X元素的最高价与最低负价代和等于2,Y的核电荷数是X的2倍,Z原子的K层和M层电子数之和与L层的电子数相等.下列说法不正确的是( )
| A、原子半径Y>Z>W |
| B、Y氧化物属于酸性氧化物 |
| C、对应的氢化物的热稳定性:W>Z |
| D、X的最高价氧化物对应的水化物弱酸 |
下列有关化学用语表示错误的是( )
| A、HCN的结构式:H-C≡N |
B、HClO的电子式为: |
C、HOCH2COOH缩聚物的结构简式: |
D、2-氯甲苯的结构简式: |
设nA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、1mol Fe与足量的稀硝酸反应,转移3nA个电子 |
| B、常温下,16g CH4含有8nA个电子(相对原子质量:C-12,H-1) |
| C、0.5 mol?L-1Na2CO3溶液中含有nA个Na+ |
| D、标准状况下,22.4L氯水含有nA个Cl2分子 |
高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性,已知:4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2↑高铁酸钾常见制备方法之一是湿法制备:在一定条件下,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液.下列说法正确的是( )
| A、K2FeO4在处理水的过程中所起的作用只有消毒杀菌 |
| B、同浓度的高铁酸钾在pH=ll.50的水溶液中比中性溶液中稳定 |
| C、湿法制备高铁酸钾,可以在酸性环境中顺利进行 |
| D、湿法制备高铁酸钾,Fe(NO3)3与NaClO物质的量之比为3:2 |
