题目内容
下列比较中,正确的是( )
| A、常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为 c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| B、物质的量浓度相等的CH3COOH和CH3COONa混合溶液中:2c(Na+)=c(CH3COO-)+c(CH3COOH) |
| C、物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中c(NH4+):①<③<② |
| D、将①0.01mol?L-1的CH3COOH溶液、②0.01mol?L-1的盐酸、③pH=12的氨水、④pH=12的NaOH溶液稀释相同倍数后溶液的pH:①<②<④<③ |
考点:离子浓度大小的比较,弱电解质在水溶液中的电离平衡,盐类水解的应用
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:A.常温下,溶液的PH=7,则c(H+)=c(OH-),再结合电荷守恒判断;
B.溶液中存在物料守恒,根据物料守恒判断;
C.亚铁离子抑制铵根离子水解,碳酸根离子促进铵根离子水解,铵根离子水解程度越大,则铵根离子浓度越小;
D.稀释时促进弱电解质电离,稀释相同的倍数后,弱酸的pH小于强酸、弱碱的pH大于强碱.
B.溶液中存在物料守恒,根据物料守恒判断;
C.亚铁离子抑制铵根离子水解,碳酸根离子促进铵根离子水解,铵根离子水解程度越大,则铵根离子浓度越小;
D.稀释时促进弱电解质电离,稀释相同的倍数后,弱酸的pH小于强酸、弱碱的pH大于强碱.
解答:
解:A.常温下,溶液的PH=7,则c(H+)=c(OH-),再结合电荷守恒得c(Cl-)=c(NH4+),故A错误;
B.溶液中存在物料守恒,根据物料守恒得2c(Na+)=c(CH3COO-)+c(CH3COOH),故B正确;
C.亚铁离子抑制铵根离子水解,碳酸根离子促进铵根离子水解,铵根离子水解程度越大,则铵根离子浓度越小,所以铵根离子浓度大小顺序是,故C错误③>②>①,故C错误;
D.稀释时促进弱电解质电离,稀释相同的倍数后,弱酸的pH小于强酸、弱碱的pH大于强碱,所以稀释100倍后溶液的pH大小顺序是③>④>①>②,故D错误;
故选B.
B.溶液中存在物料守恒,根据物料守恒得2c(Na+)=c(CH3COO-)+c(CH3COOH),故B正确;
C.亚铁离子抑制铵根离子水解,碳酸根离子促进铵根离子水解,铵根离子水解程度越大,则铵根离子浓度越小,所以铵根离子浓度大小顺序是,故C错误③>②>①,故C错误;
D.稀释时促进弱电解质电离,稀释相同的倍数后,弱酸的pH小于强酸、弱碱的pH大于强碱,所以稀释100倍后溶液的pH大小顺序是③>④>①>②,故D错误;
故选B.
点评:本题考查了离子浓度大小比较,明确物质的性质再和守恒思想分析解答,知道弱电解质的电离特点,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某烃的分子式为C8H10,不能使溴水褪色,但可使酸性KMnO4溶液褪色,则此烃的结构有( )
| A、2种 | B、3种 | C、4种 | D、5种 |
一定温度下,某容器内M、N两种物质,其物质的量随时间变化的曲线如图,下列表述中正确的是( )
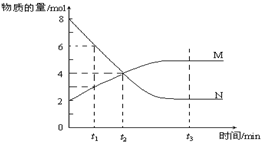

| A、该反应的化学方程式为:N?2M |
| B、t1时,正反应速率大于逆反应速率 |
| C、t2时,正逆反应速率相等,达到平衡 |
| D、t3时,M、N的浓度不再发生变化,反应停止 |
据报道,光合作用能够借助太阳能用CO2和H2制备RCH其反应原理如下:2CO2+2H2O
2HCOOH+O2,下列说法正确的是( )
| ||
| A、HCOOH分子中既有极性键,又有非极性键 |
| B、反应中,CO2被氧化,O2是还原产物 |
| C、反应中,每转移4×6.02×1023个电子,生成2.24L气体 |
| D、该过程是将太阳能转化为化学能的过程 |
下列实验操作正确的是( )
| A、用分液漏斗分离环己烷和苯的混合液体 |
| B、溴乙烷10%的烧碱溶液中,加热片刻后,冷却,先加过量的硝酸,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子 |
| C、做银镜反应实验时应将醛溶液和新制备的银氨溶液混合后充分加热至沸腾 |
| D、实验室制溴苯时选用的试剂是浓溴水、苯和铁屑 |
糖类、脂肪和蛋白质是维持人体生命活动所必须的三大营养物质.以下叙述正确的是( )
| A、植物油的主要成分是高级脂肪酸,不能使溴水褪色 |
| B、淀粉、纤维素的组成都可以用(C6H10O5)n表示,二者互为同分异构体 |
| C、进入人体的重金属盐能使蛋白质变性,所以会使人中毒 |
| D、淀粉、油脂、蛋白质都属于高分子化合物 |
要将 完全转化为
完全转化为 ,正确的方法是( )
,正确的方法是( )
 完全转化为
完全转化为 ,正确的方法是( )
,正确的方法是( )| A、与足量稀H2SO4共热后,再加足量的NaOH溶液 |
| B、与足量稀H2SO4共热后,再加入足量的Na2CO3粉末 |
| C、与足量的NaOH溶液共热后,再加入足量稀H2SO4 |
| D、与足量的NaOH溶液共热后,再通入过量的CO2 |
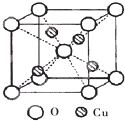 铜是过渡元素.化合物中,铜常呈现+1价或+2价.
铜是过渡元素.化合物中,铜常呈现+1价或+2价.