题目内容
开发新能源和三废处理都是可持续发展的重要方面.
(1)由碳的氧化物直接合成乙醇燃料已进入大规模生产.如采取以CO和H2为原料合成乙醇,化学反应方程式:2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g);若密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成乙醇:CO的转化率(α)与温度、压强的关系如图1所示.

①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数:K= ;
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”).
③工业上还可以采取以CO2和H2为原料合成乙醇,并且更被化学工作者推崇,但是在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH的平衡常数.请推测化学工作者认可由CO2制取CH3CH2OH的优点主要是: .
(2)目前工业上也可以用CO2来生产甲醇.一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
若将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如图2所示(实线).
①请在答题卷图中绘出甲醇的物质的量随时间变化曲线.
②仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是 ,曲线Ⅱ对应的实验条件改变是 .
(3)Hg是水体污染的重金属元素之一.水溶液中二价汞的主要存在形态与Cl-、OH-的浓度关系如图3所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-1gc(Cl-)]
①下列说法中正确的是 .
A.为了防止Hg2+水解,配制Hg(NO3)2溶液时应将Hg(NO3)2固体溶于浓硝酸后再稀释.
B.当c(Cl-)=10-1mol?L-1时,汞元素一定全部以HgCl42-形式存在
C.HgCl2是一种弱电解质,其电离方程式是:HgCl2=HgCl++Cl-
D.当溶液pH保持在4,pCl由2改变至6时,可使HgCl2转化为Hg(OH)2
②HgCl2又称“升汞”,熔点549K,加热能升华,其晶体是 (填晶体类型).
(1)由碳的氧化物直接合成乙醇燃料已进入大规模生产.如采取以CO和H2为原料合成乙醇,化学反应方程式:2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g);若密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成乙醇:CO的转化率(α)与温度、压强的关系如图1所示.

①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数:K=
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA
③工业上还可以采取以CO2和H2为原料合成乙醇,并且更被化学工作者推崇,但是在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH的平衡常数.请推测化学工作者认可由CO2制取CH3CH2OH的优点主要是:
(2)目前工业上也可以用CO2来生产甲醇.一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
若将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如图2所示(实线).
①请在答题卷图中绘出甲醇的物质的量随时间变化曲线.
②仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是
(3)Hg是水体污染的重金属元素之一.水溶液中二价汞的主要存在形态与Cl-、OH-的浓度关系如图3所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-1gc(Cl-)]
①下列说法中正确的是
A.为了防止Hg2+水解,配制Hg(NO3)2溶液时应将Hg(NO3)2固体溶于浓硝酸后再稀释.
B.当c(Cl-)=10-1mol?L-1时,汞元素一定全部以HgCl42-形式存在
C.HgCl2是一种弱电解质,其电离方程式是:HgCl2=HgCl++Cl-
D.当溶液pH保持在4,pCl由2改变至6时,可使HgCl2转化为Hg(OH)2
②HgCl2又称“升汞”,熔点549K,加热能升华,其晶体是
考点:物质的量或浓度随时间的变化曲线,化学平衡常数的含义,化学平衡的影响因素
专题:化学平衡专题
分析:(1)①平衡常数K=
;
②温度越高,反应速率越大,反应到达平衡的时间越短;
③二氧化碳的含量较大且易获取,二氧化碳减少能减轻对环境的影响;
(2)①随着反应的进行,甲醇的物质的量逐渐增大,当达到平衡状态时,参加反应的氢气物质的量=(8-2)mol=6mol,则生成n(CH3OH)=
n(H2)=2mol;
②I达到平衡的时间缩短,说明反应速率增大,但氢气的转化率减小,说明改变条件抑制平衡向正反应方向移动;
I达到平衡的时间缩短,说明反应速率增大,且氢气的转化率增大,说明改变条件促进平衡向正反应方向移动;
(3)①A.根据盐的类型判断溶液酸碱性;
B.当c(C1ˉ)=10ˉ1 mol?Lˉ1即pCl=1时,根据图象分析;
C.HgCl2是一种弱电解质,根据溶液中离子存在方式判断电解质电离方式;
D.根据图象可知当溶液pH保持在4,pCl由2改变至6时,根据图片中微粒存在方式判断;
②分子晶体的熔沸点较低.
| c(CH3CH2OH).c(H2O) |
| c2(CO).c4(H2) |
②温度越高,反应速率越大,反应到达平衡的时间越短;
③二氧化碳的含量较大且易获取,二氧化碳减少能减轻对环境的影响;
(2)①随着反应的进行,甲醇的物质的量逐渐增大,当达到平衡状态时,参加反应的氢气物质的量=(8-2)mol=6mol,则生成n(CH3OH)=
| 1 |
| 3 |
②I达到平衡的时间缩短,说明反应速率增大,但氢气的转化率减小,说明改变条件抑制平衡向正反应方向移动;
I达到平衡的时间缩短,说明反应速率增大,且氢气的转化率增大,说明改变条件促进平衡向正反应方向移动;
(3)①A.根据盐的类型判断溶液酸碱性;
B.当c(C1ˉ)=10ˉ1 mol?Lˉ1即pCl=1时,根据图象分析;
C.HgCl2是一种弱电解质,根据溶液中离子存在方式判断电解质电离方式;
D.根据图象可知当溶液pH保持在4,pCl由2改变至6时,根据图片中微粒存在方式判断;
②分子晶体的熔沸点较低.
解答:
解:(1)①当转化率为0.5时,c(CO)=
=0.5mol/L,c(H2)=
=1mol/L,
c(CH3CH2OH)=c(H2O)=
=0.25mol/L,K=
=
=0.25,故答案为:0.25;
②A的温度小于C点,温度越高,反应速率越大,则反应到达平衡的时间越短,所以tA大于tC,故答案为:大于;
③二氧化碳的含量较大且易获取,二氧化碳减少能减轻温室效应等,故答案为:原料易得、可以减轻温室效应等;
(2)①随着反应的进行,甲醇的物质的量逐渐增大,当达到平衡状态时,参加反应的氢气物质的量=(8-2)mol=6mol,则生成n(CH3OH)=
n(H2)=2mol,所以其图象为 ,
,
故答案为: ;
;
②根据图象知,I反应到达平衡的时间缩短,说明反应速率增大,但氢气的转化率减小,平衡向逆反应方向移动,则改变的条件是升高温度;
II反应到达平衡的时间缩短,说明反应速率增大,且氢气的转化率增大,说明改变条件促进平衡向正反应方向移动,则改变的条件是增大压强,
故答案为:升温;增压;
(3)①A.Hg2+水解溶液显酸性,所以为了防止Hg2+水解,配制Hg(NO3)2溶液时应将Hg(NO3)2固体溶于浓硝酸后再稀释,故A正确;
B.当c(C1ˉ)=10ˉ1 mol?Lˉ1即pCl=1时,汞元素主要是以HgCl42ˉ形式存在,故B错误;
C.HgCl2是一种弱电解质,其电离方程式是:2HgCl2?HgCl++HgCl3ˉ,故C错误;
D.根据图象可知当溶液pH保持在4,pCl由2改变至6时,可使HgCl2转化为Hg(OH)2,故D正确;
故选AD;
②HgCl2又称“升汞”,熔点549K,加热能升华,这说明晶体是分子晶体,故答案为:分子晶体.
| 10mol×(1-0.5) |
| 10L |
| 20mol×(1-0.5) |
| 10L |
c(CH3CH2OH)=c(H2O)=
| ||
| 10L |
| c(CH3CH2OH).c(H2O) |
| c2(CO).c4(H2) |
| 0.25×0.25 |
| (0.5)2.(1)4 |
②A的温度小于C点,温度越高,反应速率越大,则反应到达平衡的时间越短,所以tA大于tC,故答案为:大于;
③二氧化碳的含量较大且易获取,二氧化碳减少能减轻温室效应等,故答案为:原料易得、可以减轻温室效应等;
(2)①随着反应的进行,甲醇的物质的量逐渐增大,当达到平衡状态时,参加反应的氢气物质的量=(8-2)mol=6mol,则生成n(CH3OH)=
| 1 |
| 3 |
 ,
,故答案为:
 ;
;②根据图象知,I反应到达平衡的时间缩短,说明反应速率增大,但氢气的转化率减小,平衡向逆反应方向移动,则改变的条件是升高温度;
II反应到达平衡的时间缩短,说明反应速率增大,且氢气的转化率增大,说明改变条件促进平衡向正反应方向移动,则改变的条件是增大压强,
故答案为:升温;增压;
(3)①A.Hg2+水解溶液显酸性,所以为了防止Hg2+水解,配制Hg(NO3)2溶液时应将Hg(NO3)2固体溶于浓硝酸后再稀释,故A正确;
B.当c(C1ˉ)=10ˉ1 mol?Lˉ1即pCl=1时,汞元素主要是以HgCl42ˉ形式存在,故B错误;
C.HgCl2是一种弱电解质,其电离方程式是:2HgCl2?HgCl++HgCl3ˉ,故C错误;
D.根据图象可知当溶液pH保持在4,pCl由2改变至6时,可使HgCl2转化为Hg(OH)2,故D正确;
故选AD;
②HgCl2又称“升汞”,熔点549K,加热能升华,这说明晶体是分子晶体,故答案为:分子晶体.
点评:本题考查了平衡常数的计算、外界条件对平衡状态的影响以及溶解平衡的有关应用与判断等知识点,正确分析图象中曲线变化是解本题关键,再结合物质的性质、外界条件对化学平衡的影响等知识点来分析解答,题目难度中等.

练习册系列答案
相关题目
下列物质中,能在X射线透视肠胃时用作“钡餐”的是( )
| A、BaSO4 |
| B、BaCO3 |
| C、BaCl2 |
| D、NaCl |
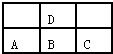 如图是元素周期表短周期的一部分,若A原子最外层的电子数比次外层的电子数少3,则下列说法中正确的是( )
如图是元素周期表短周期的一部分,若A原子最外层的电子数比次外层的电子数少3,则下列说法中正确的是( )| A、D与C不能形成化合物 |
| B、D的最高正价与B的最高正价相等 |
| C、A、B、C的最高价氧化物对应的水化物酸性强弱的关系是C>B>A |
| D、A、B、C、D原子所具有的原子轨道类型和数目都相同 |
 在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H>0,隔一段时间对该容器内的物质进行分析得到如下数据:
在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H>0,隔一段时间对该容器内的物质进行分析得到如下数据: 硫的化合物在生产和科研中发挥着重要作用.
硫的化合物在生产和科研中发挥着重要作用.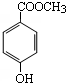 分子式为C8H8O3的芳香族化合物有多种不同的结构,这些物质在食品、化妆品等行业有广泛用途.
分子式为C8H8O3的芳香族化合物有多种不同的结构,这些物质在食品、化妆品等行业有广泛用途.