题目内容
一定条件下反应N2(g)+3H2(g)?2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内N2的反应速率为( )
| A、1.2mol/(L?min) |
| B、1mol/(L?min) |
| C、0.6mol/(L?min) |
| D、0.4mol/(L?min) |
考点:反应速率的定量表示方法
专题:
分析:已知V=10L,△t=2min,△n(N2)=20mol-8mol=12mol,带入v=
计算.
| △n |
| V?△t |
解答:
解:已知V=10L,△t=2min,△n(N2)=20mol-8mol=12mol,v(N2)=
=0.6mol/(L?min),
故选C.
| 12mol |
| 10L×2min |
故选C.
点评:本题考查了化学反应速率的计算方法,难度不大,将题目所给数据带入v=
计算即可.
| △n |
| V?△t |

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿按一定比例混合加热可制得铜:2CU2O+CU2S=6Cu+SO2↑.对于该反应,下列说法中正确的是( )
| A、该反应中的氧化剂只有Cu2O |
| B、氧化产物和还原产物的物质的量之比为1:6 |
| C、Cu既是氧化产物又是还原产物 |
| D、Cu2O在反应中既是氧化剂又是还原剂 |
在密闭容器中发生反应:aX(g)+bY(g)?cZ(g)+dW(g)反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,W的浓度为原平衡状态的1.8倍.下列叙述正确的是( )
| A、平衡向正反应方向移动 |
| B、(a+b)>(c+d) |
| C、Z的体积分数变大 |
| D、X的转化率变小 |
2007年6月,“八国峰会”再次就温室气体减排问题展开磋商并初步达成共识.为减少二氧化碳这种温室气体的排放,下列措施不切实际的是( )
| A、大力开发氢能源 |
| B、充分利用太阳能 |
| C、不使用含碳能源 |
| D、提高能源利用率 |
某电池的总反应离子方程式为Cu2++Fe=Fe2++Cu,能实现该反应的是( )
| A、正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液 |
| B、阴极为Ag,阳极为Fe,电解质溶液为CuSO4溶液 |
| C、正极为Cu,负极为Fe,电解质溶液为CuSO4溶液 |
| D、正极为石墨,负极为Fe,电解质溶液为Fe2(SO4)3溶液 |
高炉炼铁用于还原氧化铁的还原剂是( )
| A、一氧化碳 | B、焦炭 |
| C、石灰石 | D、空气 |
下列电离方程式或离子方程式正确的是( )
| A、NaHCO3电离:NaHCO3=Na++H++CO32- |
| B、H3PO4电离:H3PO4?3H++PO43- |
| C、NH4+水解:NH4++H2O?NH3?H2O+H+ |
| D、CO32-水解:CO32-+H2O?H2CO3+2OH- |
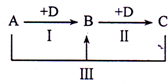 A、B、C、D表示中学化学中的四种常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).
A、B、C、D表示中学化学中的四种常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).