题目内容
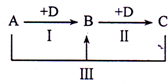 A、B、C、D表示中学化学中的四种常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).
A、B、C、D表示中学化学中的四种常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).(1)若A为强碱溶液,其焰色反应显黄色,C常用作食品添加剂,请回答下列问题:
①D的化学式是
②反应Ⅲ的离子方程式是
③现有B和C的固体混合物ag,加热至质量不再改变时剩余固体为bg,则B的质量分数为
(2)若A、D均为单质,且A为黄绿色气体,D的一种红棕色氧化物常用作颜料,则:
①反应Ⅱ的离子方程式是
②取少许C溶液于试管中,滴入NaOH溶液并振荡,发生反应的化学方程式为:
③检验B溶液中金属阳离子的方法是
考点:无机物的推断
专题:推断题
分析:(1)若A为强碱,其焰色反应显黄色,应为NaOH,C常用作食品添加剂,结合转化关系可知B为Na2CO3,C为NaHCO3,D为CO2;
(2)若A、D均为单质,且A为黄绿色气体,应为Cl2,D元素的一种红棕色氧化物常用作颜料,则D为Fe,B为FeCl3,C为FeCl2.
(2)若A、D均为单质,且A为黄绿色气体,应为Cl2,D元素的一种红棕色氧化物常用作颜料,则D为Fe,B为FeCl3,C为FeCl2.
解答:
解:(1)若A为强碱,其焰色反应显黄色,应为NaOH,C常用作食品添加剂,结合转化关系可知B为Na2CO3,C为NaHCO3,D为CO2,
①由以上分析可知D为CO2,故答案为:CO2;
②反应Ⅲ为NaHCO3和NaOH的反应,反应的离子方程式是HCO3-+OH-=H2O+CO32-,故答案为:HCO3-+OH-=H2O+CO32-;
③B为Na2CO3,C为NaHCO3,现有B和C的固体混合物ag,加热至质量不再改变时剩余固体为bg,混合物中碳酸氢钠分解产生的水和二氧化碳的质量为(a-b)g,根据关系2NaHCO3~H2O+CO2,可求得混合物中NaHCO3的质量为
g=
(a-b)g,Na2CO3的质量为ag-
(a-b)g,所以Na2CO3的质量数为
=
,
故答案为:
;
(2)若A、D均为单质,且A为黄绿色气体,应为Cl2,D元素的一种红棕色氧化物常用作颜料,则D为Fe,B为FeCl3,C为FeCl2,
①反应Ⅱ为氯化铁与铁的反应,反应的离子方程式是2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+;
②取少许氯化亚铁溶液于试管中,滴入NaOH溶液并振荡,生成氢氧化亚铁沉淀,后又被空气氧化成氢氧化铁,发生反应的化学方程式为FeCl2+2NaOH=Fe(OH)2↓+2NaCl,4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:FeCl2+2NaOH=Fe(OH)2↓+2NaCl;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
③检验FeCl3溶液中金属阳离子的方法是取溶液少许于试管中滴加KSCN溶液,若溶液变为血红色,则含有Fe3+,
故答案为:取溶液少许于试管中滴加KSCN溶液,若溶液变为血红色,则含有Fe3+.
①由以上分析可知D为CO2,故答案为:CO2;
②反应Ⅲ为NaHCO3和NaOH的反应,反应的离子方程式是HCO3-+OH-=H2O+CO32-,故答案为:HCO3-+OH-=H2O+CO32-;
③B为Na2CO3,C为NaHCO3,现有B和C的固体混合物ag,加热至质量不再改变时剩余固体为bg,混合物中碳酸氢钠分解产生的水和二氧化碳的质量为(a-b)g,根据关系2NaHCO3~H2O+CO2,可求得混合物中NaHCO3的质量为
| 84×2(a-b) |
| 62 |
| 84 |
| 31 |
| 84 |
| 31 |
a-
| ||
| a |
| 84b-53a |
| 31a |
故答案为:
| 84b-53a |
| 31a |
(2)若A、D均为单质,且A为黄绿色气体,应为Cl2,D元素的一种红棕色氧化物常用作颜料,则D为Fe,B为FeCl3,C为FeCl2,
①反应Ⅱ为氯化铁与铁的反应,反应的离子方程式是2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+;
②取少许氯化亚铁溶液于试管中,滴入NaOH溶液并振荡,生成氢氧化亚铁沉淀,后又被空气氧化成氢氧化铁,发生反应的化学方程式为FeCl2+2NaOH=Fe(OH)2↓+2NaCl,4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:FeCl2+2NaOH=Fe(OH)2↓+2NaCl;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
③检验FeCl3溶液中金属阳离子的方法是取溶液少许于试管中滴加KSCN溶液,若溶液变为血红色,则含有Fe3+,
故答案为:取溶液少许于试管中滴加KSCN溶液,若溶液变为血红色,则含有Fe3+.
点评:本题考查较为综合,涉及元素化合物的推断和应用,侧重于考查学生元素化合物知识的综合运用能量,注意掌握相关化学知识,难度中等.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
下列含羟基(OH)的有机物不属于醇的是( )
A、 |
| B、CH3OH |
C、 |
D、 |
下列关于铷(Rb)的叙述正确的是( )
| A、它位于周期表的第四周期、第ⅠA族 |
| B、在钠、钾、铷3种单质中,铷的熔点最高 |
| C、氢氧化铷是弱碱 |
| D、硝酸铷是离子化合物 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、澄清透明的溶液中:Na+、K+、MnO4-、AlO2- | ||
| B、0.1 mol?L-1 FeCl3溶液:K+、NH4+、I-、SCN- | ||
C、
| ||
| D、能溶解Al2O3的溶液:Na+、K+、Cl-、CO32- |
一定条件下反应N2(g)+3H2(g)?2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内N2的反应速率为( )
| A、1.2mol/(L?min) |
| B、1mol/(L?min) |
| C、0.6mol/(L?min) |
| D、0.4mol/(L?min) |

 命名下列有机物
命名下列有机物