题目内容
16.科研人员设想用如图所示装置生产硫酸,下列说法不正确的是( )
| A. | a为负极,b为正极 | |
| B. | b电极发生氧化反应 | |
| C. | H+从a极向b极移动 | |
| D. | 负极反应式为:SO2+2H2O-2e-=SO42-+4H+ |
分析 该原电池中,二氧化硫失电子发生氧化反应生成硫酸,所以通入二氧化硫的电极是负极、通入氧气的电极是正极,负极反应式为SO2+2H2O-2e-=SO42-+4H+,正极反应式为O2+4e-+4H+=2H2O,电子从负极沿导线流向正极,据此分析解答.
解答 解:A.该原电池中,二氧化硫失电子发生氧化反应生成硫酸,所以通入二氧化硫的电极是负极、通入氧气的电极是正极,所以a是负极、b是正极,故A正确;
B.b是正极,发生还原反应,故B错误;
C.原电池中阳离子向正极,而a是负极、b是正极,所以H+从a极向b极移动,故C正确;
D.负极上二氧化硫失电子发生氧化反应,电极反应式为SO2+2H2O-2e-=SO42-+4H+,故D正确;
故选B.
点评 本题考查化学电源新型电池,为高频考点,根据元素化合价变化确定正负极,知道各个电极发生的反应及电子流向,难点是电极反应式的书写,题目难度中等.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
6.下列有关说法正确的是( )
| A. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变不同 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大 | |
| D. | 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
7.下列各组中的反应,属于同一反应类型的是( )
| A. | 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇 | |
| B. | 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸 | |
| C. | 由氯代环己烷制环己烯;由丙烯制1,2-二溴丙烷 | |
| D. | 由乙烯制聚乙烯;由1,3-丁二烯合成顺丁橡胶 |
5.用分液漏斗可以分离的一组混合物是( )
| A. | 氯化钠和水 | B. | 水和酒精 | C. | 苯和水 | D. | 泥沙和水 |
6.乙醇汽油是用普通汽油与燃料乙醇调和而成,它可以有效改善油的性能和质量,降低一氧化碳、碳氢化合物等主要污染物的排放.1mol乙醇完全燃烧生成液态水和二氧化碳气体放出23.5kJ热量,燃烧1mol这种汽油生成液态水,放出的热量为Q kJ.测得该汽油中乙醇与汽油的物质的量之比为1:9.有关普通汽油(CxHy)燃烧的热化学方程式正确的一项是( )
| A. | CxHy(l)+(x+$\frac{y}{4}$)O2(g)═xCO2(g)+$\frac{y}{2}$H2O(l)△H=(-Q+23.5)kJ•mol-1 | |
| B. | CxHy(l)+( x+$\frac{y}{4}$)O2═xCO2+$\frac{y}{2}$H2O(l)△H=?-$\frac{9Q}{10}$?kJ•mol-1 | |
| C. | CxHy(l)+(x+$\frac{y}{4}$)O2(g)═xCO2(g)+$\frac{y}{2}$H2O(l)△H=-$\frac{9Q}{10}$ kJ•mol-1 | |
| D. | CxHy(l)+( x+$\frac{y}{4}$)O2(g)═xCO2(g)+$\frac{y}{2}$H2O(l)△H=(-$\frac{10Q}{9}$+2.61)kJ•mol-1 |
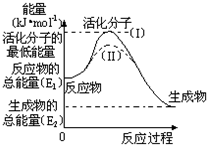 在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ•mol-1表示.请认真观察如图,然后回答问题.
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ•mol-1表示.请认真观察如图,然后回答问题.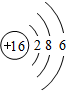 ,G元素形成的单质的结构式为Cl-Cl.
,G元素形成的单质的结构式为Cl-Cl. .
. .
.