题目内容
 某化学兴趣小组在化学实验室发现一瓶没有标签的淡黄色粉末,同学们对探究该粉末产生浓厚兴趣,并在老师的指导下进行探究活动.
某化学兴趣小组在化学实验室发现一瓶没有标签的淡黄色粉末,同学们对探究该粉末产生浓厚兴趣,并在老师的指导下进行探究活动.【提出问题】这种淡黄色粉末是什么?有什么性质和用途?
【查阅资料】①硫是淡黄色粉末,不溶于水;②过氧化钠(Na2O2)是淡黄色粉末,在常温下能与水反应生成碱和一种气体;在呼吸面具中和潜水艇里常用作供氧剂.
【猜想与探究】猜想:淡黄色粉末可能是:a.硫;b.过氧化钠;c.硫和过氧化钠的混合物.
探究:过氧化钠与水反应的生成物的成分.
【实验与结论】
| 实验操作 | 实验现象 | 实验结论 | |
| 猜想 | 在一支洁净的试管中加入适量的上述淡黄色粉末,再加入足量的蒸馏水 | 猜想a、c不成立,猜想b成立. | |
| 探究 | ①用带火星的木条伸入过氧化钠与水反应的试管中 | 木条复燃 | 生成物有 |
| ②往①试管内的溶液中滴加 | 生成物有氢氧化钠 |
| 实验操作 | 实验现象 | 实验结论 |
| ①将CO2从a口处通入装置内,再把带火星的木条放在装置b口处 | 木条复燃 | CO2在常温下能与过氧化钠反应,该反应的化学方程式为: |
| ②取出充分反应后的固体生成物于试管中,往试管内滴加稀盐酸,将生成的氢气通入澄清石灰水中 | 有气泡产生 石灰水变浑浊 |
考点:性质实验方案的设计
专题:实验设计题
分析:本实验是探究型的实验,对应淡黄色固体进行确认,主要利用他们的化学性质,硫不与水反应,而过氧化钠与足量的水完全反应生成能助燃的气体,说明该气体是氧气,对反应后的溶液加酚酞试液后会变红,说明还有碱氢氧化钠产生;过氧化钠还能与二氧化碳反应生成能助燃的气体,说明该气体是氧气,另一产物与石灰水反应产生沉淀,说明是碳酸钠.
解答:
解:【实验与结论】在一支洁净的试管中加入适量的上述淡黄色粉末,再加入足量的蒸馏水,固体全部溶解,并能生成助燃的气体,说明该气体是氧气;对反应后的溶液加酚酞试液后会变红,说明还有碱氢氧化钠产生,
故答案为:
【继续探究】过氧化钠还能与二氧化碳反应生成能助燃的气体,说明该气体是氧气,另一产物与石灰水反应产生沉淀,说明是碳酸钠;故答案为:2Na2O2+2CO2=2Na2CO3+O2;
【交流与比较】与我们学过的制氧气方法相比,常选用过氧化钠作为呼吸面具和潜水艇的供氧剂,装置简单,原料易得,在常温下过氧化钠就能与水、二氧化碳反应生成供人呼吸的氧气反应,故答案为:装置简单,原料易得,在常温下过氧化钠能与水、二氧化碳反应生成供人呼吸的氧气.
故答案为:
| 实验操作 | 实验现象 | 实验结论 | |
| 猜想 | 有气泡产生,固体无剩余 | ||
| 探究 | 氧气 | ||
| 无色酚酞试液 | 酚酞变红 |
【交流与比较】与我们学过的制氧气方法相比,常选用过氧化钠作为呼吸面具和潜水艇的供氧剂,装置简单,原料易得,在常温下过氧化钠就能与水、二氧化碳反应生成供人呼吸的氧气反应,故答案为:装置简单,原料易得,在常温下过氧化钠能与水、二氧化碳反应生成供人呼吸的氧气.
点评:该实验具有实际意义,属于身边的化学,平时要多留心,多积累,做到触类旁通.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列叙述中正确的是( )
| A、不可用澄清石灰水鉴别Na2CO3和NaHCO3溶液 |
| B、1mol过氧化钠与2 mol碳酸钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是纯净物 |
| C、等质量的NaHCO3和Na2 CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同 |
| D、可利用焰色反应来鉴别Na2CO3和NaHCO3固体 |
一定条件下,在体积为2L的密闭容器中,3molX和3mol Y发生反应:3X(g)+Y(g)═2Z(g),经60s达到平衡,生成0.4molZ.下列说法正确的是( )
| A、60s内反应速率为v(X)=0.05 mol/(L?s),X的转化率为80% | ||
B、其它条件不变,将容器体积变为4L,Z的平衡浓度变为原来的
| ||
| C、其它条件不变,若升高温度,X的体积分数增大,则该反应的△H>0 | ||
| D、其它条件不变,若初始投入2mol X和2mol Y则物质Y的转化率减小 |
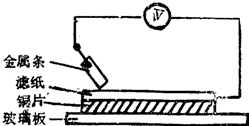 如图所示实验中,把四根洁净的金属条A、B、C、D轮流放置在浸有盐溶液的滤纸上面并压紧.在每次轮流实验时,记录了电压表指针的移动方向和电压表的读数(如下表).下列说法中正确的是( )
如图所示实验中,把四根洁净的金属条A、B、C、D轮流放置在浸有盐溶液的滤纸上面并压紧.在每次轮流实验时,记录了电压表指针的移动方向和电压表的读数(如下表).下列说法中正确的是( )| 金属 | 电子流动方向 | 电压 |
| A | A→Cu | +0.78 |
| B | Cu→B | -2.15 |
| C | C→Cu | +1.35 |
| D | +0.30 |
| A、金属D与Cu之间电子流动方向为Cu→D |
| B、A金属可能是最强的还原剂 |
| C、B金属不能从硫酸铜溶液中置换铜 |
| D、B金属可能是最强的还原剂 |
 热力学标准态(298K、101kPa)下,由稳定单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H),图为氧族元素氢化物a、b、c、d的生成热数据示意图,(氧族元素包括氧、硫、硒、碲).试完成下列问题:
热力学标准态(298K、101kPa)下,由稳定单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H),图为氧族元素氢化物a、b、c、d的生成热数据示意图,(氧族元素包括氧、硫、硒、碲).试完成下列问题:
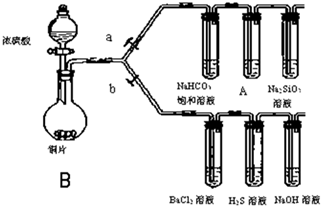 根据要求完成下列各小题实验目的.(如图a、b为弹簧夹,加热及固定装置已略去)
根据要求完成下列各小题实验目的.(如图a、b为弹簧夹,加热及固定装置已略去)