题目内容
一定温度下,难溶电解质在饱和溶液中各离子浓度幂的乘积是一个常数,这个常数称为该难溶电解质的溶度积,用符号Ksp表示.即:AmBn(s)?mAn+(aq)+nBm-(aq)[An+]m?[Bm-]n=Ksp
已知:某温度时,Ksp(AgCl)=[Ag+][Cl-]=1.8×10-10 Ksp(Ag2CrO4)=[Ag+]2[CrO2-4]=1.1×10-12
试求:此温度下,在0.010mo1?L-1的AgNO3溶液中,AgCl与Ag2CrO4分别能达到的最大物质的量浓度.
已知:某温度时,Ksp(AgCl)=[Ag+][Cl-]=1.8×10-10 Ksp(Ag2CrO4)=[Ag+]2[CrO2-4]=1.1×10-12
试求:此温度下,在0.010mo1?L-1的AgNO3溶液中,AgCl与Ag2CrO4分别能达到的最大物质的量浓度.
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:在0.010mo1?L-1的AgNO3溶液中c(Ag+)=0.010mo1?L-1,根据Ksp(AgCl)、Ksp(Ag2CrO4)计算出溶液中c(Cl-)、c(CrO42-)的最大值,即AgCl与Ag2CrO4分别能达到的最大物质的量浓度.
解答:
解:在0.010mo1?L-1的AgNO3溶液中c(Ag+)=0.010mo1?L-1,形成AgCl饱和溶液时Cl-浓度:c(Cl-+)=
=
=1.8×10-8 mol/L,则c(AgCl)=1.8×10-8 mol/L,
形成Ag2CrO4饱和溶液时CrO42-的浓度:c(CrO42-)=
mol/L=
=1.1×10-8 mol/L,则c(Ag2CrO4)=1.1×10-8 mol/L,
答:AgCl与Ag2CrO4分别能达到的最大物质的量浓度分别为1.8×10-8 mol/L,1.1×10-8 mol/L.
| Ksp(AgCl) |
| c(Ag+) |
| 1.8×10-10 |
| 0.01 |
形成Ag2CrO4饱和溶液时CrO42-的浓度:c(CrO42-)=
| Ksp(Ag2CrO4) |
| c2(Ag+) |
| 1.1×10-12 |
| 0.012 |
答:AgCl与Ag2CrO4分别能达到的最大物质的量浓度分别为1.8×10-8 mol/L,1.1×10-8 mol/L.
点评:本题考查了溶度积常数的计算,侧重于公式应用的考查,题目难度中等,注意把握溶度积常数的含义和计算方法.

练习册系列答案
相关题目
分类在科学研究中必须用的方法,下列关于化学的分类说法正确的是( )
| A、干冰、HD均为化合物;水玻璃、水银均为混合物;纯碱和生石灰分别属于碱和氧化物;蔗糖、PVC、淀粉都是高分子化合物 |
| B、根据一个酸分子电离产生氢离子的个数将酸分为一元酸、二元酸等 |
| C、由于饱和碳酸钙的导电性比饱和氨水的导电性弱,所以碳酸钙是弱电解质 |
| D、根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素 |
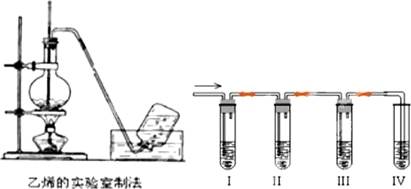
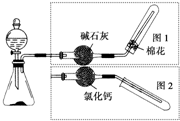 如图是实验室制取气体的装置,其中发生装置相同,干燥和集气装置有两套,分别用图1和图2表示.下列选项中正确的是( )
如图是实验室制取气体的装置,其中发生装置相同,干燥和集气装置有两套,分别用图1和图2表示.下列选项中正确的是( )| 发生装置中的药品 | 干燥和集气装置 | |
| A | 铜和稀硝酸 | 图2 |
| B | 氧化钙和浓氨水 | 图2 |
| C | 锌和稀盐酸 | 图1 |
| D | 大理石和稀盐酸 | 图1 |
| A、A | B、B | C、C | D、D |
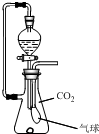 在抽滤瓶内放一小块金属钠,同时收集满CO2气体并塞紧瓶塞.从分液漏斗中放入一定量的水,待钠完全反应并恢复到反应前温度时,发现气球凹瘪,则抽滤瓶内溶液中的溶质是( )
在抽滤瓶内放一小块金属钠,同时收集满CO2气体并塞紧瓶塞.从分液漏斗中放入一定量的水,待钠完全反应并恢复到反应前温度时,发现气球凹瘪,则抽滤瓶内溶液中的溶质是( )| A、NaOH与Na2CO3 |
| B、Na2CO3 |
| C、Na2CO3与NaHCO3 |
| D、NaHCO3 |
污水处理厂检测出一批污水中含有较多的重金属Ag+,欲将其除去,应加入适量的( )
| A、NaCl |
| B、BaSO4 |
| C、Al2O3 |
| D、HNO3 |