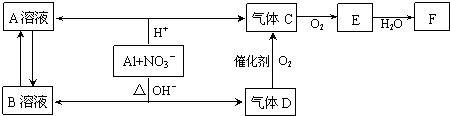
题目内容
(1)工业上可用氨与Cl2反应检验输送氯气的管道是否漏气,反应方程式如下:8NH3+3Cl2═6NH4Cl+N2.
①请在上述方程式中表示出电子转移的方向和数目.
②该反应中, 是还原剂;若反应中有1.5mol氧化剂参与反应,则发生转移的电子的物质的量为 mol,被氧化的物质有 mol.
(2)将Cl2通入淀粉-KI溶液中会发现无色溶液变成蓝色,在蓝色溶液中继续通入Cl2或SO2后又褪色.这是因为 (填序号)
a.Cl2与KI发生置换反应生成I2,I2遇淀粉变蓝色
b.HClO将蓝色物质漂白
c.SO2将蓝色物质漂白
d.Cl2继续将I2氧化生成HIO3而使溶液褪色
e.SO2将I2还原而使溶液褪色
请写出有关化学反应方程式:(可以不填满)① ;② ;③ .
①请在上述方程式中表示出电子转移的方向和数目.
②该反应中,
(2)将Cl2通入淀粉-KI溶液中会发现无色溶液变成蓝色,在蓝色溶液中继续通入Cl2或SO2后又褪色.这是因为
a.Cl2与KI发生置换反应生成I2,I2遇淀粉变蓝色
b.HClO将蓝色物质漂白
c.SO2将蓝色物质漂白
d.Cl2继续将I2氧化生成HIO3而使溶液褪色
e.SO2将I2还原而使溶液褪色
请写出有关化学反应方程式:(可以不填满)①
考点:氧化还原反应,氯气的化学性质
专题:氧化还原反应专题,元素及其化合物
分析:(1)化学反应3Cl2+8NH3=6NH4Cl+N2中,Cl元素化合价由0→-1价,N元素化合价由-3价→价,氧化还原反应氧化剂与还原剂得失电子数目相等;
(2)无色溶液变成蓝色,发生2I-+Cl2═I2+2Cl-,在蓝色溶液中继续通入Cl2或SO2后又褪色,发生Cl2继续将I2氧化生成HIO3或I2+SO2+2H2O═2I-+SO42-+4H+,以此来解答.
(2)无色溶液变成蓝色,发生2I-+Cl2═I2+2Cl-,在蓝色溶液中继续通入Cl2或SO2后又褪色,发生Cl2继续将I2氧化生成HIO3或I2+SO2+2H2O═2I-+SO42-+4H+,以此来解答.
解答:
解:(1)①化学反应3Cl2+8NH3=6NH4Cl+N2中,Cl元素化合价由0→-1价,N元素化合价由-3价→价,氧化还原反应氧化剂与还原剂得失电子数目相等,表现为化合价升降总数相等,用双线桥标出电子转移的方向和数目可为 ,故答案为:
,故答案为: ;
;
②N元素的化合价升高,则NH3为还原剂,有1.5mol氧化剂参与反应,由Cl元素的化合价变化可知发生转移的电子的物质的量为1.5mol×2×(1-0)=3mol,由反应可知,3mol氧化剂与2mol还原剂转移电子守恒,则被氧化的物质有1.5mol×
=1mol,故答案为:NH3;3;1;
(2)由信息可知,无色溶液变成蓝色,发生2KI+Cl2=I2+2KCl,在蓝色溶液中继续通入Cl2或SO2后又褪色,发生I2+5Cl2+6H2O═2HIO3+10HCl或I2+SO2+2H2O═H2SO4+2HI,只有a、d、e符合题意,故答案为:a、d、e;2KI+Cl2=I2+2KCl;I2+5Cl2+6H2O═2HIO3+10HCl;I2+SO2+2H2O═H2SO4+2HI.
 ,故答案为:
,故答案为: ;
;②N元素的化合价升高,则NH3为还原剂,有1.5mol氧化剂参与反应,由Cl元素的化合价变化可知发生转移的电子的物质的量为1.5mol×2×(1-0)=3mol,由反应可知,3mol氧化剂与2mol还原剂转移电子守恒,则被氧化的物质有1.5mol×
| 2 |
| 3 |
(2)由信息可知,无色溶液变成蓝色,发生2KI+Cl2=I2+2KCl,在蓝色溶液中继续通入Cl2或SO2后又褪色,发生I2+5Cl2+6H2O═2HIO3+10HCl或I2+SO2+2H2O═H2SO4+2HI,只有a、d、e符合题意,故答案为:a、d、e;2KI+Cl2=I2+2KCl;I2+5Cl2+6H2O═2HIO3+10HCl;I2+SO2+2H2O═H2SO4+2HI.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与计算能力的综合,注意(2)中现象与反应的分析为解答的难点,题目难度中等.

练习册系列答案
相关题目
体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g) 2HI(g);(正反应为吸热反应),当达到平衡后,t0时升高温度,下列说法正确的是( )
| A、容器内气体颜色变深,平均相对分子质量不变 |
| B、平衡不移动,混合气体密度增大 |
| C、H2转化率增大,HI平衡浓度变小 |
D、 改变条件前后,速率图象为(如图) |
下列各组有机物,无论以何种物质的量的比例混合,只要总物质的量一定,则完全燃烧消耗氧气的量为一恒定值的是( )
| A、C3H6和C3H8 |
| B、C2H6O和C2H4 |
| C、C5H8和C6H6 |
| D、C2H6和C3H8 |
下列排列顺序错误的是( )
| A、金属性 Rb>K>Mg>Al |
| B、非金属性 As>S>Cl>F |
| C、稳定性 AsH3>PH3>H2S>HF |
| D、半径 Na>P>O>F |
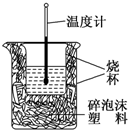 50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
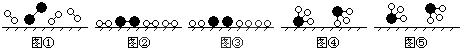
 、
、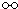 、
、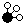 分别表示N2、H2、NH3,图⑤表示生成的NH3离开催化剂表面,则图③的含义是
分别表示N2、H2、NH3,图⑤表示生成的NH3离开催化剂表面,则图③的含义是