题目内容
(1)在25℃时,向100mL含氯化氢14.6g的盐酸溶液里放入5.60g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2min末,收集到1.12L(标准状况)氢气.在此之后,又经过4min,铁粉完全溶解.则:前2min与后4min相比,反应速率较快的是 ,其原因是 .
(2)在1×105Pa和25℃时,H-H键、N≡N键和N-H键的键能分别为436kJ/mol、945kJ/mol和391kJ/mol,
①根据上表中的数据判断工业合成氨的反应是 (填“吸热”或“放热”)反应;
②在25℃时,取1mol氮气和3mol氢气放入一密闭容器中,在催化剂存在下进行反应.理论上放出或吸收的热量为Q1,则Q1为 KJ;
③实际生产中,放出或吸收的热量为Q2,Q1与Q2比较,正确的是 A. Q1>Q2 B. Q1<Q2C. Q1=Q2如此选择的理由 .
(2)在1×105Pa和25℃时,H-H键、N≡N键和N-H键的键能分别为436kJ/mol、945kJ/mol和391kJ/mol,
①根据上表中的数据判断工业合成氨的反应是
②在25℃时,取1mol氮气和3mol氢气放入一密闭容器中,在催化剂存在下进行反应.理论上放出或吸收的热量为Q1,则Q1为
③实际生产中,放出或吸收的热量为Q2,Q1与Q2比较,正确的是
考点:化学反应速率的影响因素,有关反应热的计算,反应热和焓变,反应热的大小比较
专题:基本概念与基本理论
分析:(1)随着反应的进行,氢离子浓度逐渐减小,反应速率逐渐减小;
(2)①根据反应物、生成物键能的相对大小判断该反应是发热反应还是吸热反应;
②根据化学反应的反应热知识,反应物与生成物的键能差即为热量Q1;
③合成氨是可逆反应,反应物不能完全转化为生成物.
(2)①根据反应物、生成物键能的相对大小判断该反应是发热反应还是吸热反应;
②根据化学反应的反应热知识,反应物与生成物的键能差即为热量Q1;
③合成氨是可逆反应,反应物不能完全转化为生成物.
解答:
解:(1)前2分钟,n(H2)=
=0.05mol,则消耗0.1molHCl,0.05molFe,质量为0.05mol×56g/mol=2.8g,又经过4min,铁粉完全溶解,即后4min消耗2.8g铁,则前2分钟反应速率较大,主要原因是前2分钟氢离子浓度大,随着反应的进行,氢离子浓度逐渐降低,反应速率逐渐减小,
故答案为:前2分钟;氢离子浓度大;
(2)①形成化学键放出能量,破坏化学键吸收能量;N2+3H2
2NH3,
Q=生成物的键能-反应物的键能=2×3×391KJ-945KJ-3×436>0,所以该反应是放热反应,故答案为:放热;
②Q1=生成物的键能-反应物的键能=2×3×391KJ-945KJ-3×436=93kJ,故答案为:93kJ;
③Q1的数值是按完全转化计算出来的,而合成氨是可逆反应,开始时加入的1 mol N2和3 mol H2不能完全反应生成2 mol NH3,所以,Q1>Q2,
故答案为:A;该反应为可逆反应,在密闭容器中进行反应达到平衡时,1 mol N2和3 mol H2不能完全反应生成2 mol NH3,因而放出热量小于93 kJ.
| 1.12L |
| 22.4L/mol |
故答案为:前2分钟;氢离子浓度大;
(2)①形成化学键放出能量,破坏化学键吸收能量;N2+3H2
| 高温高压 |
| 催化剂 |
Q=生成物的键能-反应物的键能=2×3×391KJ-945KJ-3×436>0,所以该反应是放热反应,故答案为:放热;
②Q1=生成物的键能-反应物的键能=2×3×391KJ-945KJ-3×436=93kJ,故答案为:93kJ;
③Q1的数值是按完全转化计算出来的,而合成氨是可逆反应,开始时加入的1 mol N2和3 mol H2不能完全反应生成2 mol NH3,所以,Q1>Q2,
故答案为:A;该反应为可逆反应,在密闭容器中进行反应达到平衡时,1 mol N2和3 mol H2不能完全反应生成2 mol NH3,因而放出热量小于93 kJ.
点评:本题综合考查了化学反应速率以及键能与反应热的关系,为高频考点,注意把握浓度对化学反应速率的影响,注意形成化学键放出能量,破坏化学键吸收能量,反应热=形成化学键放出能量-破坏化学键吸收能量,难度不大.

练习册系列答案
相关题目
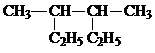 名称:
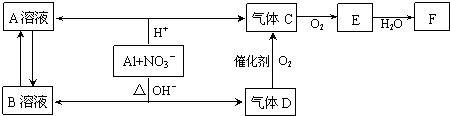
名称: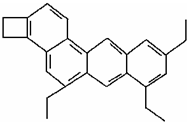
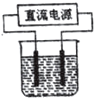 以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一.
以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一.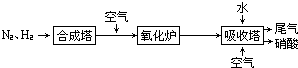
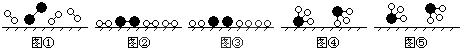
 、
、 、
、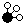 分别表示N2、H2、NH3,图⑤表示生成的NH3离开催化剂表面,则图③的含义是
分别表示N2、H2、NH3,图⑤表示生成的NH3离开催化剂表面,则图③的含义是