��Ŀ����
13��NA���������ӵ�������ֵ������������ȷ���ǣ�������| A�� | ��������1 L pH=1�Ĵ�����Һ�м�ˮ��������Һ��OH-��Ŀ����0.1NA | |
| B�� | 60g�����������Ҵ�����������Ӧ����ַ�Ӧ��������ѵ�C-O����ĿΪNA | |
| C�� | ��֪C2H4��g��+H2��g��=C2H6��g����H=-137.0 kI/mol����ϩ��H2�ӳ�ʱ�ų�68.5 kJ�������� ��Ӧ�����б��ƻ���̼ԭ��֮�乲�õ��Ӷ���ĿΪNA | |
| D�� | 4.6gSO2��NO2��������к���������Ϊ2.3 NA |
���� A��������ʼ�ˮϡ�ʹٽ�����룻
B���������Ҵ�����������ӦΪ���淴Ӧ�����淴Ӧ���ܽ��е��ף�
C�������Ȼ�ѧ����ʽC2H4��g��+H2��g���TC2H6��g����H=-137.0 kI/mol����֪������1mol��ϩ�ƻ�1mol̼̼˫����
D������������Ҫ������ԭ�Ӻ��ϣ�������+������=��������ԭ�Ӷ���������=��������
��� �⣺A����������1 L pH=1�Ĵ�����Һ�к���H+��Ŀ0.1NA����ˮϡ�ͣ��������̶�������������������࣬��A��ȷ��
B.60g�������ʵ���Ϊ1mol���������Ҵ�����������Ӧ����Ϊ������ӦΪ���淴Ӧ�����Գ�ַ�Ӧ����ѵ�C-O����ĿС��NA����B����
C����֪C2H4��g��+H2��g���TC2H6��g����H=-137.0 kI/mol����ϩ��H2�ӳ�ʱ�ų�68.5 kJ��������Ӧ�����б��ƻ���̼ԭ��֮�乲�õ��Ӷ���ĿΪ0.5NA����C����
D���⼸��Ԫ�أ�S��O��N��ԭ�Ӷ���������=������������������������������Ժ������Ӻ����Ӹ�2.3g�����ӡ����ӵ�Ħ����������Ϊ1g/mol�����Ժ����������ʵ���2.3mol��������Ϊ2.3 NA����D��ȷ��
��ѡAD��
���� ���⿼�鰢���ӵ��������ۺ�Ӧ�ã���Ŀ�Ѷ��еȣ�ע�����պ������ʵ���Ϊ���ĵĸ���ѧ���밢���ӵ������Ĺ�ϵ����ȷ���淴Ӧ�ص㣬�л���ṹ�������ǽ���ؼ���

 ��У����ϵ�д�
��У����ϵ�д�| A�� | 1molNa��O2��Ӧ�õ�32g��������ʧȥ������ΪNA | |
| B�� | ��1mL0.1mol•L-1FeCl3��Һ�Ƶõ�����������������������Ϊ10-4NA | |
| C�� | 12g���ʯ�к��еĹ��ۼ���Ϊ2NA | |
| D�� | ��״���£�22.4LCH4�к��е�̼ԭ����ΪNA |
��1����֪��CH3OH��l��+$\frac{3}{2}$O2��g���TCO2��g��+2H2O��l����H=-725.5kJ•mol-1
H2��g��+$\frac{1}{2}$O2��g���TH2O��l����H=-285.8kJ•mol-1
����ͼ1��ʾ��ҵ����CO2��g����H2��g��Ϊԭ�Ϻϳɸü״���Ӧ�������仯ʾ��ͼ����ȷ����a������ĸ���ţ���
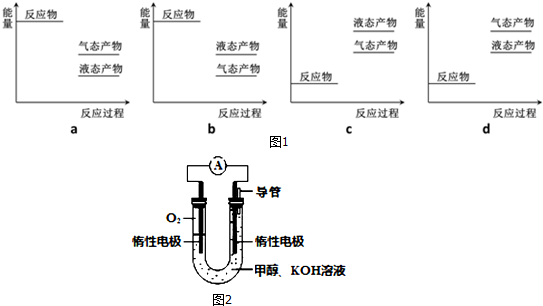
��2��CO��H2��ӦҲ�ܺϳɼ״���CO��g��+2H2��g��?CH3OH��g����H=-90.1kJ•mol-1����250���£���һ������CO��H2Ͷ��10L�ĺ����ܱ������У������ʵ�Ũ�ȣ�mol•L-1���仯���±���ʾ��ǰ6minû�иı���������
| 2min | 4min | 6min | 8min | �� | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | �� |
| H2 | x | 0.12 | 0.12 | 0.2 | �� |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | �� |
����6��8minʱֻ�ı���һ����������ı�������dz���һ����H2����8minʱ���÷�Ӧ�Ƿ�ﵽƽ��״̬�����ǣ���ǡ����ǡ�����
���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ���BD������ţ���
A�������¶�
B����CH3OH��g������ϵ�з���
C������He��ʹ��ϵ��ѹǿ����
D���ٳ���1mol CO��3mol H2
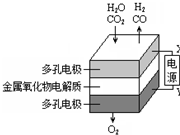
��3��ijʵ��С�����ݼ״�ȼ�յķ�Ӧԭ���������ͼ��ʾ�ĵ��װ�ã�
�ٸõ�ظ����ĵ缫��ӦΪCH3OH-6e-+8OH-=CO32-+6H2O��
�ڸõ�ع���ʱ����Һ�е�OH-���ƶ���
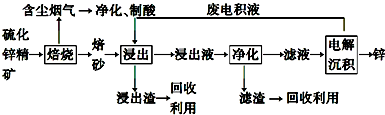
 �ڹ�̬��������������У����¹����H2O-CO2��������Ʊ�H2��CO��һ���µ���Դ���÷�ʽ������ԭ����ͼ��ʾ������˵����ȷ���ǣ�������
�ڹ�̬��������������У����¹����H2O-CO2��������Ʊ�H2��CO��һ���µ���Դ���÷�ʽ������ԭ����ͼ��ʾ������˵����ȷ���ǣ�������| A�� | X�ǵ�Դ������ | |
| B�� | �����ķ�Ӧʽ�ǣ�4OH--4e��=2H2O+O2�� | |
| C�� | �ܷ�Ӧ�ɱ�ʾΪ��H2O+CO2=H2+CO+O2 | |
| D�� | �������������ɵ���������ʵ���֮����1��1 |


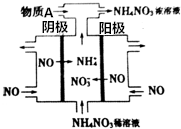 ��ͼ������N2H4-KOH-O2Ϊ��Դ���NO�Ʊ�NH4NO3���乤��ԭ����ͼ��ʾ��
��ͼ������N2H4-KOH-O2Ϊ��Դ���NO�Ʊ�NH4NO3���乤��ԭ����ͼ��ʾ��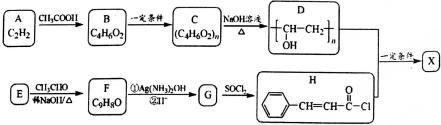
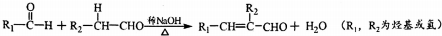
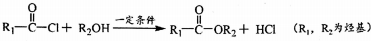
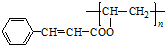 ��
��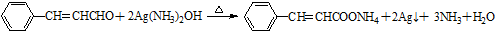 ��
�� ��
��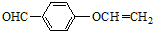 ��
��