题目内容
17.超重元素的假说预言自然界中可能存在114号的稳定同位素${\;}_{114}^{298}X$,请根据原子结构理论和元素周期律预测:(1)114X元素位于元素周期表中第七周期,IVA族,为金属元素(金属或非金属)
(2)写出该元素最高价氧化物及其水化物的分子式XO2、X(OH)4,并估计后者为碱性(填酸、两性、碱)
(3)该元素与氯生成化合物的分子式XCl2、XCl4.
分析 (1)用元素的质子数减去每一周期容纳元素种数,当余数小于某周期容纳元素种数时,元素处于该周期,余数为列数,若余数大于18,则余数减去14为列数;
最外层电子数≤周期数为金属元素,最外层电子数>周期数为非金属元素;
(2)根据价电子判断其最高价氧化物及其水合物的化学式,根据元素周期律判断氧化物的水合物的酸碱性;
(3)根据所处的族判断化合价,书写氯化物化学式.
解答 解:(1)114号元素的质子数为114,则114-2-8-8-18-18-32=28,所以该元素位于第7周期,余数为28大于18,所以该元素所处列数为28-14=14,第16列为IVA族,所以该元素处于第7周期IVA族,该元素最外层电子数4<周期数7,所以为金属元素,
故答案为:七;IVA;金属;
(2)主族元素的最高化合价数=其最外层电子数,所以其最高价氧化物的化学式为:XO2,其最高价氧化物的水合物是该氧化物与水反应的生成物,所以是X(OH)4,同主族自上而下金属性增强,该元素金属性强,X(OH)4应呈碱性,
故答案为:XO2; X(OH)4; 碱性;
(3)位于第ⅣA族,常见的价态为+2、+4,该元素与氯生成化合物的分子式为XCl2、XCl4,
故答案为:XCl2、XCl4.
点评 本题考查结构与位置关系,关键是确定元素在周期表位置,结合元素周期律解答,可以根据稀有气体的原子序数、核外电子排布式等确定在周期表中位置.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.如表为元素周期表的一部分,X、Y、Z、W 为短周期元素,其中
Z 元素的原子最外层电子数是其核电荷数的$\frac{3}{4}$.下列说法不正确的是( )
| X | Y | Z |
| W | ||
| T |
| A. | Y、W、T元素的原子半径及它们气态氢化物的还原性均依次递增 | |
| B. | Z氢化物的沸点一定比 X氢化物的沸点高 | |
| C. | X、Y元素形成的常见单质的化学键类型相同 | |
| D. | 根据元素周期律,可以推测存在化学式为T2Z3、X3Y4的两种物质,T元素存在同素异形现象 |
5.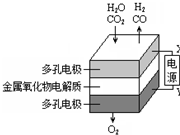 在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法正确的是( )
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法正确的是( )
 在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法正确的是( )
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法正确的是( )| A. | X是电源的正极 | |
| B. | 阳极的反应式是:4OH--4eˉ=2H2O+O2↑ | |
| C. | 总反应可表示为:H2O+CO2=H2+CO+O2 | |
| D. | 阴、阳两极生成的气体的物质的量之比是1:1 |
12.下列关系的表述中正确的是( )
| A. | 向NaHSO3溶液中通入NH3至中性,溶液中存在:c(NH4+)>c(SO32-) | |
| B. | NH4Cl和NH3•H2O混合液pH=7,一定存在c(NH4+)=c(Cl-) | |
| C. | NaHCO3溶液中存在HCO3-+H2O?H3O++CO32-,加水稀释后c(H+)减小 | |
| D. | pH相同的氯化铵与硫酸亚铁铵两种溶液中铵根离子浓度前者大 |
5.如表所示的是关于有机物A、B的信息:
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的产物的名称为1,2-二溴乙烷.
(2)B具有的性质是②③⑦(填序号).
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤能使酸性KMnO4溶液和溴水褪色 ⑥任何条件下均不与氢气反应 ⑦与溴水混合后液体分层且上层呈橙红色
(3)A的同系物用通式CnHm表示,B的同系物用通式CxHy表示,当CnHm、CxHy分别出现同分异构体时,碳原子数的最小值n=4,x=8.
| A | B |
| ①能使溴的四氯化碳溶液褪色 ②分子比例模型为 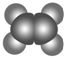 ③能与水在一定条件下反应 | ①由C、H两种元素组成 ②分子球棍模型为 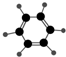 |
(1)A与溴的四氯化碳溶液反应的产物的名称为1,2-二溴乙烷.
(2)B具有的性质是②③⑦(填序号).
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤能使酸性KMnO4溶液和溴水褪色 ⑥任何条件下均不与氢气反应 ⑦与溴水混合后液体分层且上层呈橙红色
(3)A的同系物用通式CnHm表示,B的同系物用通式CxHy表示,当CnHm、CxHy分别出现同分异构体时,碳原子数的最小值n=4,x=8.

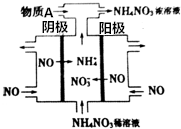 如图是利用N2H4-KOH-O2为电源点解NO制备NH4NO3,其工作原理如图所示:
如图是利用N2H4-KOH-O2为电源点解NO制备NH4NO3,其工作原理如图所示: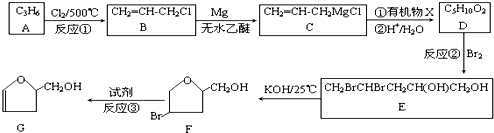
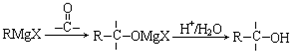
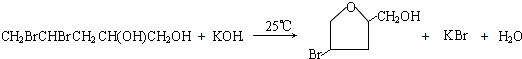 ;
;