题目内容
18.ClO2是一种杀菌消毒效率高、二次污染小的水处理剂.实验室中可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2ClO2↑+K2SO4+2CO2↑+2H2O. 下列说法不正确的是( )| A. | 1mol KClO3参加反应,转移2mol电子 | |
| B. | KClO3在反应中被还原 | |
| C. | H2C2O4的还原性强于ClO2 | |
| D. | CO2是H2C2O4被氧化后得到的产物 |
分析 2KClO3+H2C2O4+H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$2ClO2↑+K2SO4+2CO2↑+2H2O(O均为-2价)中,Cl元素的化合价由+5价降低为+4价,C元素的化合价由+3价升高到+4价,以此来解答.
解答 解:A.1mol KClO3参加反应,转移1mol电子,故A错误;
B.该反应中草酸是还原剂,在反应中被氧化,KClO3是氧化剂反应中被还原,故B正确;
C.该反应中草酸是还原剂,二氧化氯是还原产物,所以草酸的还原性大于ClO2的还原性,故C正确;
D.该反应中C元素的化合价由+3价升高到+4价,所以草酸是还原剂,则二氧化碳是氧化产物,故D正确;
故选A.
点评 本题考查氧化还原反应,明确元素化合价变化是解本题关键,难度不大.

练习册系列答案
相关题目
3.化学与人类生产、生活、社会可持续发展密切相关.下列说法正确的是( )
| A. | 玛瑙手饰所用材料的主要成分为硅酸盐 | |
| B. | 汽油去油污、焰色反应、煤的气化均属于物理变化 | |
| C. | 用CO2合成聚碳酸酯可降解塑料,可以实现“碳”的循环利用 | |
| D. | 利用太阳能电池电解法将CO和H2O转化为甲酸的能量转化方式只有一种 |
9. 已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,探究不同的初始pH和草酸溶液浓度对反应速率的影响,设计如下实验,则A=2,C=50,E=10
(2)该反应的离子方程式5H2C2O4+2MnO4-+6H+=10CO2+2Mn2++8H2O.
(3)若t1<t2,则根据实验①和②得到的结论是其他条件相同时,溶液的初始pH越小,该反应的反应速率越快.
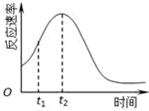
(4)小组同学发现每组实验反应速率随时间的变化总是如图,其中t1~t2时间内速率变快的主要原因可能是:
①该反应放热;②产物Mn2+是反应的催化剂.
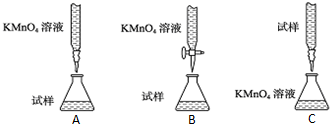
(5)化学小组用滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O4•2H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定三次,平均消耗KMnO4溶液VmL.滴定到达终点的现象是:滴入最后一滴KMnO4溶液,溶液呈浅紫红色,且30秒内不恢复;实验中所需的定量仪器有托盘天平、250mL容量瓶、酸式滴定管(填仪器名称).该KMnO4溶液的物质的量浓度为$\frac{20a}{63V}$mol/L.
 已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:(1)常温下,探究不同的初始pH和草酸溶液浓度对反应速率的影响,设计如下实验,则A=2,C=50,E=10
| 实验编号 | 温度 | 初始pH | 0.1mol/L草酸溶液体积/mL | 0.01mol/LKMnO4 溶液体积/mL | 蒸馏水体积/mL | 待测数据(混合液褪色时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | A | B | C | 30 | t2 |
| ③ | 常温 | 2 | 40 | D | E | t3 |
(3)若t1<t2,则根据实验①和②得到的结论是其他条件相同时,溶液的初始pH越小,该反应的反应速率越快.
(4)小组同学发现每组实验反应速率随时间的变化总是如图,其中t1~t2时间内速率变快的主要原因可能是:
①该反应放热;②产物Mn2+是反应的催化剂.
(5)化学小组用滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O4•2H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定三次,平均消耗KMnO4溶液VmL.滴定到达终点的现象是:滴入最后一滴KMnO4溶液,溶液呈浅紫红色,且30秒内不恢复;实验中所需的定量仪器有托盘天平、250mL容量瓶、酸式滴定管(填仪器名称).该KMnO4溶液的物质的量浓度为$\frac{20a}{63V}$mol/L.
6.下列有关实验操作、现象和解释或结论都正确的是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| B | 往待测液中滴加硝酸银溶液 | 有白色沉淀出现 | 待测液中含有Cl- |
| C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| A. | A | B. | B | C. | C | D. | D |
3.决定气体体积的主要微观因素是( )
| A. | 气体分子的数目和分子本身的大小 | |
| B. | 气体分子的质量和分子本身的大小 | |
| C. | 气体分子本身的大小和分子间的平均距离 | |
| D. | 气体分子的数目和分子间的平均距离 |
8.Se、Br两种元素的部分信息如图所示,下列说法正确的是( )
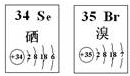

| A. | 原子半径:Br>Se>P | B. | 还原性:S 2 ->Se 2 ->Br - | ||
| C. | SeO 2既有氧化性又有还原性 | D. | 在Se2Br2分子中只含有极性键 |
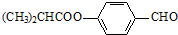 .合成M的一种途径如下:
.合成M的一种途径如下:
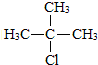 ,D中官能团的名称是羧基.
,D中官能团的名称是羧基.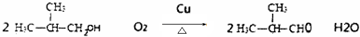 .
. .
.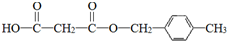 .
.