题目内容
10.工业上以铁和石墨为电极,电解K2MnO4溶液来制取KMnO4.①电解时,应以铁棒(填“铁棒”或“石墨”)作阴极,电解时阴极产生H2,则电解过程中pH较大的是阴(填“阴”或“阳”)极区.
②电解的化学方程式为2K2MnO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2KOH+2KMnO4+H2↑.
分析 电解K2MnO4溶液制取KMnO4,要用隋性电极作阳极,铁作阴极,则阳极上K2MnO4失去电子发生氧化反应,阴极上是水中的氢离子放电生成氢气,据此分析.
解答 解:①电解K2MnO4溶液制取KMnO4,要用隋性电极作阳极,铁作阴极,则阳极上K2MnO4失去电子发生氧化反应,阴极上是水中的氢离子放电生成氢气,所以阴极附近有氢氧根离子产生,溶液的pH将会增大,
故答案为:铁棒;阴;
②阳极上K2MnO4失去电子发生氧化反应,阴极上是水中的氢离子放电生成氢气,所以电解的化学方程式为2K2MnO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2KOH+2KMnO4+H2↑;
故答案为:2K2MnO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2KOH+2KMnO4+H2↑.
点评 本题考查了电解原理的应用,注意把握电极上离子的放电顺序以及电极方程式,题目难度不大,侧重于基础知识的考查.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
15.下列叙述正确的是( )
| A. | CH3CH2Br的沸点比CH3CH3的沸点高 | |
| B. | 所有卤代烃都能够发生水解反应和消去反应 | |
| C. | 溴乙烷与Na0H水溶液共热生成乙烯 | |
| D. | 在溴乙烷中加入AgN03溶液,立即产生淡黄色沉淀 |
18.ClO2是一种杀菌消毒效率高、二次污染小的水处理剂.实验室中可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2ClO2↑+K2SO4+2CO2↑+2H2O. 下列说法不正确的是( )
| A. | 1mol KClO3参加反应,转移2mol电子 | |
| B. | KClO3在反应中被还原 | |
| C. | H2C2O4的还原性强于ClO2 | |
| D. | CO2是H2C2O4被氧化后得到的产物 |
5.X、Y、Z、W均为短周期元素,X、Y处于同一主族,X的最低价和Z的最高价离子的半径关系为X2->Z2+,W的单质是空气的组成成分之一,且与X、Y、Z均不在同一周期中.下列说法一定正确的是( )
| A. | 原子序数:Z>X>W | |
| B. | 单质的沸点:Z>X | |
| C. | 原子的最外层电子数:Y>W>Z | |
| D. | 标准状况下,5.6LW的单质中含有0.5mol原子 |
15.X、Y、Z、M、Q是中学化学常见的五种元素,原子序数依次增大,其结构或性质信息如表:
(1)Q元素基态原子的电子排布式是:1s22s22p63s23p63d64s2.比Q元素原子序数大3的元素的原子结构示意图为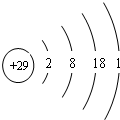 .
.
(2)比较Y元素与氧元素的第一电离能大小顺序N>O;X和Z形成的化合物XZ2为一种液体溶剂,其电子式为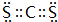 .
.
(3)写出实验室制备M单质的离子方程式:MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++2H2O.
(4)M的气态氢化物和氟化氢相比稳定性强的是HF>HCl (写化学式):
| 元素 | 结构或性质信息 |
| X | 其原子最外层电子数是内层电子数的2倍 |
| Y | 基态原子最外层电子排布为nsnnpn+1 |
| Z | 非金属元素,其单质为固体,在氧气中燃烧时有明亮的蓝紫色火焰 |
| M | 单质在常温、常压下是气体.基态原子的M层上有1个未成对的p电子 |
| Q | 其与X形成的合金为目前用量最多的金属材料 |
 .
.(2)比较Y元素与氧元素的第一电离能大小顺序N>O;X和Z形成的化合物XZ2为一种液体溶剂,其电子式为
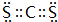 .
.(3)写出实验室制备M单质的离子方程式:MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++2H2O.
(4)M的气态氢化物和氟化氢相比稳定性强的是HF>HCl (写化学式):
19.下列关于元素周期律的叙述正确的是( )
| A. | 随着元素原子序数的递增,原子最外层电子总是从1到8重复出现 | |
| B. | 随着元素原子序数的递增,同周期从左到右原子半径从小到大(稀有气体除外)发生周期性变化 | |
| C. | 随着元素原子序数的递增,元素最高正价从+1到+7、负价从-7到-1重复出现 | |
| D. | 元素原子核外电子排布的周期性变化是导致原子半径、元素主要化合价和元素性质周期性变化的主要原因 |