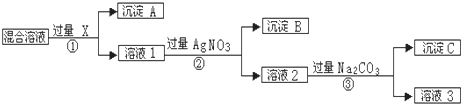
题目内容
17.常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++H2O2+2H+=2Fe3++2H2O 2Fe3++H2O2=2Fe2++O2↑+2H+,由此说明:(1)H2O2的氧化性比Fe3+强,其还原性比Fe2+强(填“强”或“弱”)
(2)在H2O2分解过程中,FeSO4溶液 的作用是催化剂.
分析 根据氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,结合具体的化学反应来解答.
解答 解:(1)由2Fe2++H2O2+2H+=2Fe3++2H2O、2Fe3++H2O2=2Fe2++O2↑+2H+可知,H2O2的氧化性>Fe3+的氧化性,H2O2的还原性>Fe2+的还原性,故答案为:强;强;
(2)将两个反应相加可得2H2O2=2H2O+O2↑,所以分解过程中,Fe2+作催化剂,所以FeSO4溶液 的作用是催化剂,故答案为:催化剂.
点评 本题考查氧化还原反应,明确反应中氧化性的比较规律及两个化学反应的关系及催化剂在反应在的作用即可解答,难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
8.下列离子方程式书写正确的是( )
| A. | 铜和稀硝酸反应 Cu+4H++NO3-=Cu2++2H2O+NO↑ | |
| B. | 碳酸氢钠和过量的澄清石灰水反应 2HCO3-+2OH-+Ca2+=CaCO3↓+2H2O+CO32- | |
| C. | Fe投入盐酸中 2Fe+6H+=2Fe3++3H2↑ | |
| D. | 氢氧化铝溶于氢氧化钠溶液 Al(OH)3+OH-=AlO2-+2H2O |
12.推理是化学学习中常用的思维方法.以下推理正确的是( )
| A. | 碱溶液的pH大于7,Ba(OH)2是碱,所以氢氧化钡溶液的pH大于7 | |
| B. | 点燃H2和O2混合气体可能爆炸,所以点燃H2与CO的混合气体也可能爆炸 | |
| C. | 中和反应生成盐和水,所以生成盐和水的反应一定是中和反应 | |
| D. | 蜡烛燃烧生成CO2和H2O,所以蜡烛组成里一定含有碳元素、氢元素和氧元素 |
2.下列依据相关实验得出的结论不正确的是( )
| A. | 向溶液X中滴加盐酸无明显现象,再滴加BaCl2溶液有白色沉淀生成,则X中含有SO42- | |
| B. | 向饱和FeCl3溶液中滴加少量氨水,可制取Fe(OH)3胶体 | |
| C. | 检验某补铁药片(主要成分为亚铁化合物)是否氧化变质,使用KSCN溶液 | |
| D. | 向1mL l% NaOH溶液加入2 mL 2%的CuSO4溶液,振荡后滴加0.5 mL 5%葡萄糖溶液,加热,未出现红色沉淀,证明葡萄糖中不含醛基 |
7.下列叙述正确的是( )
| A. | 温度不变,向NH3•H2O溶液中加入NH4Cl,平衡左移,电离平衡常数减小 | |
| B. | pH=12的NH3•H2O溶液加水稀释10倍后,其pH=11 | |
| C. | 向氯化银的浊液中加入少量氯化钠,则氯化银的溶解程度减小 | |
| D. | 在0.1mol•L-1 Na2S溶液中,有c(Na+)+C(H+)=c(S2-)+C(OH-)+C(HS-) |
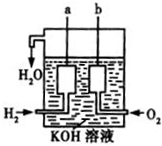 氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g)═2H2O(l)△H=-572kJ/mol请回答下列问题:
氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g)═2H2O(l)△H=-572kJ/mol请回答下列问题: