题目内容
6.现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl─、SO42─、和NO3─的相互分离.相应的实验过程可用图表示:请回答下列问题:
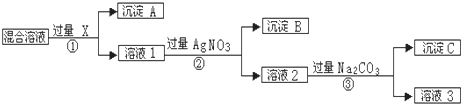
(1)写出实验流程中下列物质的化学式:试剂X:BaCl2[或Ba(NO3)2],沉淀B:AgCl.
(2)上述实验流程中加入过量的Na2CO3的目的是除去过量的Ba2+、Ag+.
(3)按此实验方案得到的溶液3中肯定含有Na2CO3(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的HNO3.
分析 实验室分离含NaCl、Na2SO4和NaNO3的混合物,实现Cl-、SO42-、和NO3-的相互分离,可在混合物中加入BaCl2或Ba(NO3)2,生成BaSO4沉淀,发生反应为Ba2++SO42-=BaSO4↓,然后加入过量的AgNO3生成AgCl沉淀,反应的离子方程式为Cl-+Ag+=AgCl↓,最后加入过量的Na2CO3,使溶液中的Ag+、Ba2+完全沉淀,过滤之后,加入稀HNO3溶液从而得到NaNO3,以此解答该题.
解答 解:(1)如先加入AgNO3,则会同时生成Ag2SO4和AgCl沉淀,则应先加入过量的BaCl2[或Ba(NO3)2],生成BaSO4沉淀,然后在滤液中加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,则试剂X为BaCl2[或Ba(NO3)2],沉淀A为BaSO4,沉淀B为AgCl,
故答案为:BaCl2[或Ba(NO3)2];AgCl;
(2)加入过量的BaCl2[或Ba(NO3)2],然后在滤液中加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,在所得滤液中含有Ag+、Ba2+,在所得滤液中加入过量的Na2CO3,使溶液中的Ag+、Ba2+完全沉淀,
故答案为:除去过量的Ba2+、Ag+;
(3)在所得滤液中加入过量的Na2CO3,最后所得溶液3为NaNO3和Na2CO3的混合物,杂质为Na2CO3,解决此问题可加入稀HNO3,最后进行蒸发操作可得固体NaNO3,
故答案为:Na2CO3;HNO3.
点评 本题考查物质的分离提纯综合应用,为高频考点,题目难度中等,本题注意Cl-、SO42-的性质,把握除杂原则,提纯时不能引入新的杂质,注意把握实验的先后顺序.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.下列变化属于物理变化的有( )
| A. | 用加热的方法分离沙子和氯化铵晶体 | |
| B. | 用洁净的铂丝蘸取氯化钠溶液在无色火焰上灼烧,焰色呈黄色 | |
| C. | 胆矾受热变成白色粉末 | |
| D. | 熔融的氯化钠导电 |
14.设NA表示阿伏加德罗常数值,下列叙述正确的是( )
| A. | NA个氧气分子和NA个氢气分子的质量比为16:1 | |
| B. | 54g H2O中含有的水分子数为3NA个 | |
| C. | 11.2L 氯气中含有的原子数为NA个 | |
| D. | 2L 1mol/L Na2SO4溶液中Na+离子数为2NA个 |
1.下列表述正确的是( )
| A. | 比例模型 可以表示甲烷分子,也可以表示四氯化碳分子 可以表示甲烷分子,也可以表示四氯化碳分子 | |
| B. | 2CH3CH2OD+O2$→_{△}^{Cu}$2CH3CHO+2DHO | |
| C. | 石油的分馏和煤的干馏都是发生了物理变化 | |
| D. | 用 CH3CH218OH 与乙酸反应制取乙酸乙酯,18O 存在于水中 |
18.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 78 g苯含有CC双键的数目为3NA | |
| C. | 常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA |
16.下列电子式书写错误的是( )
| A. |  | B. |  | C. |  | D. |  |
