题目内容
2.下列依据相关实验得出的结论不正确的是( )| A. | 向溶液X中滴加盐酸无明显现象,再滴加BaCl2溶液有白色沉淀生成,则X中含有SO42- | |
| B. | 向饱和FeCl3溶液中滴加少量氨水,可制取Fe(OH)3胶体 | |
| C. | 检验某补铁药片(主要成分为亚铁化合物)是否氧化变质,使用KSCN溶液 | |
| D. | 向1mL l% NaOH溶液加入2 mL 2%的CuSO4溶液,振荡后滴加0.5 mL 5%葡萄糖溶液,加热,未出现红色沉淀,证明葡萄糖中不含醛基 |
分析 A.先加盐酸排除干扰离子,加氯化钡生成的白色沉淀为硫酸钡;
B.FeCl3溶液中滴加少量氨水生成沉淀;
C.铁离子遇KSCN溶液为血红色;
D.NaOH不足,检验葡萄糖应在碱性条件下.
解答 解:A.先加盐酸排除干扰离子,加氯化钡生成的白色沉淀为硫酸钡,则X中含有SO42-,故A正确;
B.FeCl3溶液中滴加少量氨水生成沉淀,应在沸水中加氯化铁制备胶体,故B错误;
C.铁离子遇KSCN溶液为血红色,则检验某补铁药片(主要成分为亚铁化合物)是否氧化变质,使用KSCN溶液,若变红可知变质,故C正确;
D.NaOH不足,检验葡萄糖应在碱性条件下,则该实验不能证明葡萄糖中是否含醛基,故D错误;
故选BD.
点评 本题考查化学实验方案的评价,为高频考点,把握离子检验、胶体制备、有机物的性质、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
13. 如图把气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )
如图把气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )
 如图把气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )
如图把气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )| 选项 | 气怵 | A中试剤 | B中试剤 |
| A | SO2、CO2 | 酸性KMnO4溶液 | 品红溶液 |
| B | Cl2、HC1 | 浓硫酸 | KI淀粉溶液 |
| C | NH3、CO2 | 浓硫酸 | 酚酞试液 |
| D | CO2、HC1 | NaOH溶液 | 澄清石灰水 |
| A. | A | B. | B | C. | C | D. | D |
10.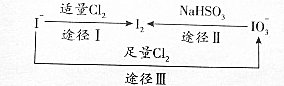 碘在地壳中主要以NaIO3的形式存在.在海水中主要以I-的形式存在.几种粒子之间有如图转化关系,根据如图转化关系推测下列说法不正确的是( )
碘在地壳中主要以NaIO3的形式存在.在海水中主要以I-的形式存在.几种粒子之间有如图转化关系,根据如图转化关系推测下列说法不正确的是( )
 碘在地壳中主要以NaIO3的形式存在.在海水中主要以I-的形式存在.几种粒子之间有如图转化关系,根据如图转化关系推测下列说法不正确的是( )
碘在地壳中主要以NaIO3的形式存在.在海水中主要以I-的形式存在.几种粒子之间有如图转化关系,根据如图转化关系推测下列说法不正确的是( )| A. | 可用KI-淀粉试纸和食醋检验加碘盐中是否含有碘 | |
| B. | 在碘水中通入Cl2,发生反应的化学方程为5Cl2+I2+6H2O=2HIO3+10HCI | |
| C. | 由图可知氧化性的强弱顺序为Cl2>I2>IO3 | |
| D. | 途径Ⅲ中,若消耗1moICl2,反应中转移的电子为2moI |
7.分子式为C4H802,且一定条件下能与NaOH溶液反应,其可能结构有(不含立体异构)( )
| A. | 2种 | B. | 4种 | C. | 6种 | D. | 8种 |
14.设NA表示阿伏加德罗常数值,下列叙述正确的是( )
| A. | NA个氧气分子和NA个氢气分子的质量比为16:1 | |
| B. | 54g H2O中含有的水分子数为3NA个 | |
| C. | 11.2L 氯气中含有的原子数为NA个 | |
| D. | 2L 1mol/L Na2SO4溶液中Na+离子数为2NA个 |
12.把500mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀,该混合溶液中钾离子浓度为( )
| A. | 10 (b-2a)mol•L-1 | B. | 5(b-2a)mol•L-1 | C. | 2(b-a)mol•L-1 | D. | 10(2a-b)mol•L-1 |