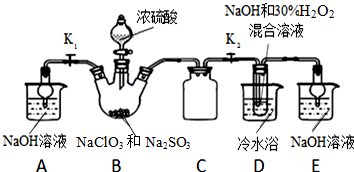
题目内容
11.A是用途最广的金属,B、C是常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显血红色,它们相互转化关系如图所示.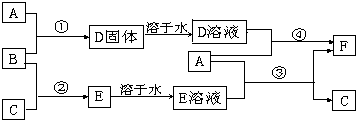
请回答:
(1)写出B物质的化学式:Cl2;F的化学式:FeCl2.
(2)A在一定的条件下可与水蒸气发生反应,反应的化学反应方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.写出第④步反应的离子方程式2Fe3++Fe=3Fe2+.
(3)F溶液中滴入NaOH溶液可能产生的实验现象是先生成白色絮状沉淀,迅速变成灰绿色,最后变成红褐色;
(4)将D的饱和溶液滴加到沸水中可以制得一种胶体,写出该反应的化学反应方程式FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl.
(5)在100mL的F溶液中通入标准状况224mLCl2,F溶液恰好转化成D溶液,则原F溶液的物质的量浓度为0.2mol•L-1.
分析 A是用途最广的金属,则A为Fe;D溶液中滴加KSCN溶液显红色,则D中含有铁离子,B、C是常见的气体单质,E溶液为常见强酸,则B为Cl2,C为H2,E为HCl,D为FeCl3,F为FeCl2,据此解答.
解答 解:A是用途最广的金属,则A为Fe;D溶液中滴加KSCN溶液显红色,则D中含有铁离子,B、C是常见的气体单质,E溶液为常见强酸,则B为Cl2,C为H2,E为HCl,D为FeCl3,F为FeCl2.
(1)根据上述推断可知,B为Cl2,F为FeCl2,
故答案为:Cl2;FeCl2;
(2)铁在一定条件下与水蒸气反应生成Fe3O4和氢气,反应的化学方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,第④步反应为Fe与氯化铁反应生成氯化亚铁,离子反应方程式为2Fe3++Fe=3Fe2+,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;2Fe3++Fe=3Fe2+;
(3)F为FeCl2,其溶液中滴入NaOH溶液反应生成氢氧化亚铁白色沉淀,最终被氧化为红褐色的氢氧化铁沉淀,观察到现象为:先生成白色絮状沉淀,迅速变成灰绿色,最后变成红褐色,
故答案为:先生成白色絮状沉淀,迅速变成灰绿色,最后变成红褐色;
(4)根据上述分析,D为FeCl3,将FeCl3的饱和溶液滴加到沸水中可以制得氢氧化铁胶体,该反应的化学反应方程式为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl,
故答案为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl;
(5)根据上述推断,F为FeCl2,224mL氯气的物质的量为0.01mol,在100mL的FeCl2 的溶液中通入标准状况Cl2 0.01mol,FeCl2溶液恰好转化成FeCl3 溶液,发生反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,则原FeCl2 溶液的物质的量浓度为0.02mol÷0.1L=0.2mol•L-1,
故答案为:0.2mol•L-1.
点评 本题考查无机物的推断、常见化合物的性质、胶体的制备、物质的量浓度的计算等知识,比较基础,注意对元素化合物性质掌握.

 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案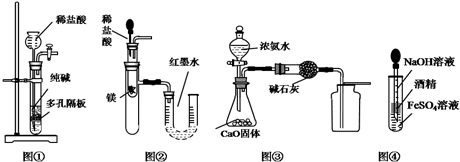
| A. | 用图①所示装置制取少量纯净的CO2气体 | |
| B. | 用图②所示装置验证镁和盐酸反应的热效应 | |
| C. | 用图③所示装置制取并收集干燥纯净的NH3 | |
| D. | 用图④装置制备Fe(OH)2并能保证较长时间观察到白色 |
| A. | 充电过程是化学能转化为电能的过程 | |
| B. | 充电时阳极反应:Ni(OH)2-e-+OH-═NiOOH+H2O | |
| C. | 放电时负极附近溶液的酸性增强 | |
| D. | 放电时电解质溶液中的OH-向正极移动 |
| A. | 通入澄清石灰水 | B. | 用湿润的蓝色石蕊试纸 | ||
| C. | 用品红溶液 | D. | 根据气体有无颜色 |
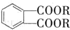 (代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示:
(代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示: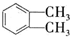 $→_{①光照}^{Cl_{2}}$[A]$\stackrel{②}{→}$[B]$→_{③△}^{Cu、O_{2}}$[C]$\stackrel{④}{→}$[D]$→_{⑤ROH/△}^{浓硫酸}$[DMP]
$→_{①光照}^{Cl_{2}}$[A]$\stackrel{②}{→}$[B]$→_{③△}^{Cu、O_{2}}$[C]$\stackrel{④}{→}$[D]$→_{⑤ROH/△}^{浓硫酸}$[DMP]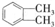 的名称1,2-二甲苯(或邻二甲苯),C中官能团的名称为醛基,DMP的分子式为C10H10O4.
的名称1,2-二甲苯(或邻二甲苯),C中官能团的名称为醛基,DMP的分子式为C10H10O4.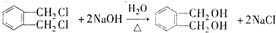 .
. .
.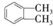 制备DMP的另一种途径:
制备DMP的另一种途径: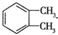 $→_{O_{2}①}^{催化剂、△}$
$→_{O_{2}①}^{催化剂、△}$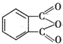 $→_{F②}^{适当条件}$[DMP]
$→_{F②}^{适当条件}$[DMP] (1)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为PbO2+4HCl(浓)=PbCl2+Cl2↑+2H2O.PbO2可由PbO与次氯酸钠溶液反应制得,其反应的离子方程式为PbO+ClO-=PbO2+Cl-.
(1)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为PbO2+4HCl(浓)=PbCl2+Cl2↑+2H2O.PbO2可由PbO与次氯酸钠溶液反应制得,其反应的离子方程式为PbO+ClO-=PbO2+Cl-.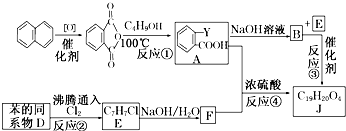
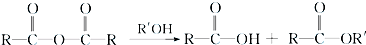
 +RCl→
+RCl→ +NaCl;
+NaCl; .
. .
. .
.