题目内容
4.某天然有机化合物A仅含C、H、O元素,与A相关的变化如下(部分反应产物已略去):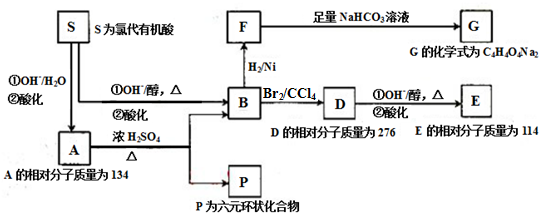
(1)化合物B的官能团名称是碳碳双键和羧基,B→F的反应类型为加成反应或还原反应.
(2)写出下列反应的化学方程式或离子方程式:
S→B的第①步:HOOCCHClCH2COOH+3OH--OOCCH=CHCOO-+Cl-+3H2O.
A→P:
 .
.D→E的第①步:HOOCCHBrCHBrCOOH+4OH--OOCC≡CCOO-+2Br-+4H2O.
(3)n mol A发生缩聚反应生成(n-1)mol H2O时,所得链状聚酯的结构简式为
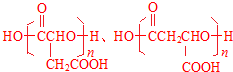 .
.(4)写出与D具有相同官能团的D的所有同分异构体的结构简式:
 .
.
分析 由A仅含C、H、O三种元素,S为氯代有机酸,水解可以得到A,说明S分子中含有C、H、O、Cl四种元素;根据反应条件可知,由S→B发生消去,B→F发生加成,得到饱和羧酸F,而F和NaHCO3反应,得到盐的化学式为:C4H4O4Na2,说明F是二元羧酸,从而说明S分子中含有两个-COOH.
S中的Cl原子碱性条件下被-OH取代,生成含有-COOH和-OH的有机物A,并且A自身在浓硫酸作用下,可以生成六元环状的酯,故-OH在β碳原子上,再结合A的相对分子质量分为134,可以推知A为HOOCCHOHCH2COOH,S为 ,B为HOOCCH=CHCOOH,F为HOOCCH2CH2COOH,D为
,B为HOOCCH=CHCOOH,F为HOOCCH2CH2COOH,D为 ,D在NaOH醇溶液中发生消去,生成E:HOOCC≡CCOOH,P为六元环酯,结构简式为
,D在NaOH醇溶液中发生消去,生成E:HOOCC≡CCOOH,P为六元环酯,结构简式为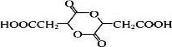 ,据此分析解答.
,据此分析解答.
解答 解:由A仅含C、H、O三种元素,S为氯代有机酸,水解可以得到A,说明S分子中含有C、H、O、Cl四种元素;根据反应条件可知,由S→B发生消去,B→F发生加成,得到饱和羧酸F,而F和NaHCO3反应,得到盐的化学式为:C4H4O4Na2,说明F是二元羧酸,从而说明S分子中含有两个-COOH.
S中的Cl原子碱性条件下被-OH取代,生成含有-COOH和-OH的有机物A,并且A自身在浓硫酸作用下,可以生成六元环状的酯,故-OH在β碳原子上,再结合A的相对分子质量分为134,可以推知A为HOOCCHOHCH2COOH,S为 ,B为HOOCCH=CHCOOH,F为HOOCCH2CH2COOH,D为
,B为HOOCCH=CHCOOH,F为HOOCCH2CH2COOH,D为 ,D在NaOH醇溶液中发生消去,生成E:HOOCC≡CCOOH,P为六元环酯,结构简式为
,D在NaOH醇溶液中发生消去,生成E:HOOCC≡CCOOH,P为六元环酯,结构简式为 ,
,
(1)B为HOOCCH=CHCOOH,分子中含有碳碳双键和羧基两种官能团,B发生加成反应或还原反应生成F,
故答案为:碳碳双键、羧基;加成(或还原)反应;
(2)S→B的第①步:HOOCCHClCH2COOH+3OH--OOCCH=CHCOO-+Cl-+3H2O,
A→P: ;
;
D→E的第①步:HOOCCHBrCHBrCOOH+4OH--OOCC≡CCOO-+2Br-+4H2O;
故答案为:HOOCCHClCH2COOH+3OH--OOCCH=CHCOO-+Cl-+3H2O; ;
;
HOOCCHBrCHBrCOOH+4OH--OOCC≡CCOO-+2Br-+4H2O;
(3)n mol A发生缩聚反应生成(n-1)mol H2O时,所得链状聚酯的结构简式为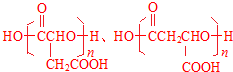 ,故答案为:
,故答案为: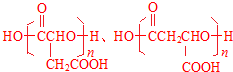 ;
;
(4)与D具有相同官能团的D的所有同分异构体的结构简式为 ,故答案为:
,故答案为: .
.
点评 本题考查有机物的推断,涉及烯、卤代烃、醇、醛、羧酸、酯等性质与转化、有关计算、同分异构体书写等,题目综合性较大,是对有机化学知识的综合考查,侧重考查学生的分析能力、思维能力,正确推断A结构是解本题关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案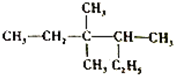
| A. | 2-乙基-3,3-二甲基戊烷 | B. | 3,3,4-三甲基己烷 | ||
| C. | 3,3-甲基-4乙基戊烷 | D. | 2,3,3-三甲基己烷 |
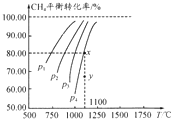 在一容积不变的密闭容器中充入0.1mol/LCO2和0.1mol/LCH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g).测得平衡时CH4的转化率与温度、压强的关系如图.下列有关说法正确的是( )
在一容积不变的密闭容器中充入0.1mol/LCO2和0.1mol/LCH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g).测得平衡时CH4的转化率与温度、压强的关系如图.下列有关说法正确的是( )| A. | 上述反应的△H<0 | |
| B. | 压强P1>P2>P3>P4 | |
| C. | 1100℃时该反应的平衡常数约为1.64 | |
| D. | 压强为P4时,y点的v正<v逆 |
| A. | C在反应中被还原 | B. | S和KNO3都发生了还原反应 | ||
| C. | CO2是反应的氧化产物 | D. | K2S和N2都是反应的还原产物 |
| A. | 用Ba(N03)2溶液鉴别CaCl2溶液和(NH4)2SO4溶液 | |
| B. | 用稀硫酸鉴别碳酸钠固体和碳酸钾固体 | |
| C. | 用湿润的蓝色石蕊试纸鉴别氨气和氢气 | |
| D. | 用淀汾溶液鉴别加碘盐(含KI03)和未加碘盐 |
 (1)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为PbO2+4HCl(浓)=PbCl2+Cl2↑+2H2O.PbO2可由PbO与次氯酸钠溶液反应制得,其反应的离子方程式为PbO+ClO-=PbO2+Cl-.
(1)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为PbO2+4HCl(浓)=PbCl2+Cl2↑+2H2O.PbO2可由PbO与次氯酸钠溶液反应制得,其反应的离子方程式为PbO+ClO-=PbO2+Cl-.