题目内容
反应A(g)+3B(g)═2C(g)+2D(g),在四种不同的情况下的反应速率分别为:
①v(A)=0.2mol?(L?s)-1
②v(B)=0.6mol?(L?s)-1
③v(C)=0.3mol?(L?s)-1
④v(D)=0.5mol?(L?s)-1
该反应进行最快的是( )
①v(A)=0.2mol?(L?s)-1
②v(B)=0.6mol?(L?s)-1
③v(C)=0.3mol?(L?s)-1
④v(D)=0.5mol?(L?s)-1
该反应进行最快的是( )
| A、① | B、② | C、③ | D、④ |
考点:化学反应速率和化学计量数的关系
专题:化学反应速率专题
分析:不同物质表示的速率之比等于其化学计量数之比,故各物质表示的反应速率与其化学计量数之比越大,反应速率越快,注意反应速率单位要相同.
解答:
解:不同物质表示的速率之比等于其化学计量数之比,故各物质表示的反应速率与其化学计量数之比越大,反应速率越快,
①
=0.2mol?(L?s)-1
②
=0.2mol?(L?s)-1
③
=0.15mol?(L?s)-1
④
=0.25mol?(L?s)-1
所以反应速率v(D)>v(A)=v(B)>v(C),
故选D.
①
| v(A) |
| 1 |
②
| v(B) |
| 3 |
③
| v(C) |
| 2 |
④
| v(D) |
| 2 |
所以反应速率v(D)>v(A)=v(B)>v(C),
故选D.
点评:本题考查反应速率快慢比较,难度不大,常用的两种方法:(1)归一法:将同一反应中的不同物质的反应速率转化成同一物质的反应速率,再较小比较.(2)比值法:用各物质的量表示的反应速率除以对应各物质的化学计量数,数值大的反应速率快.

练习册系列答案
相关题目
已知氢气在氯气中燃烧.在反应过程中,破坏1mol氢气中的化学键消耗的能量为Q1KJ,破坏1mol氯气中的化学键消耗的能量为Q2KJ,形成1molHCl中的H-Cl键释放的能量为Q3KJ.下列正确的是( )
| A、Q1+Q2>Q3 |
| B、参加反应的H2、Cl2总能量大于生成物HCl的总能量 |
| C、Q1+Q2<2Q3 |
| D、参加反应的H2、Cl2总能量小于生成物HCl的总能量 |
对于体积固定的密闭容器中进行的反应2SO2(气)+O2(气)?2SO3(气),下列判断正确的是( )
| A、容器内气体的密度保持不变 |
| B、当反应达到平衡状态时,SO3一定完全分解 |
| C、反应速率之比为v(SO2):v(O2):v(SO3)=2:1:2时,反应达到平衡 |
| D、反应达到平衡后,降低温度,平衡不发生移动 |
下列各组离子在溶液能大量共存的是( )
| A、Mg2+、K+、SO42-、NO3- |
| B、Na+、OH-、NH4+、HCO3- |
| C、Al3+、K+、SO32-、ClO- |
| D、AlO2-、H+、Fe3+、Cl- |
下列物质不能通过煤的干馏得到的是( )
| A、焦炭 | B、粗苯 | C、粗氨水 | D、硝酸 |
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、1 mol N2所含有的原子数为NA |
| B、标准状况下,16 g NH3中含有的分子数为NA |
| C、标准状况下,22.4 L氯化氢所含的原子数为NA |
| D、500 mL 1.0 mol?L-1硫酸钠溶液中所含的钠离子数为NA |
下列离子方程式正确的是( )
| A、钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
| B、碳酸钠溶液中加入澄清石灰水 Ca(OH) 2+CO32-=CaCO3↓+2OH- |
| C、氢氧化钡溶液与稀H2SO4 反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| D、将氯气溶于水制备次氯酸:Cl2+H2O=H++Cl-+HClO |
上海自主研发了一种氢燃料汽车.它是以30%KOH溶液为电解质的氢氧燃料电池,下列有关说法中,不正确的是( )
| A、正极反应:O2+2H2O+4e-═4OH- |
| B、发生氧化反应的是负极 |
| C、当正极消耗22.4LH2时,负极11.2LO2消耗(相同条件) |
| D、氢氧燃料电池不仅能量转化率高,而且产物是水,属于环境友好电池 |
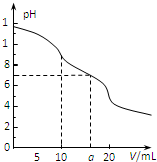 常温下,用 0.1mol?L-1 HCl溶液滴定10.0mL浓度为0.1mol?L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法不正确的是( )
常温下,用 0.1mol?L-1 HCl溶液滴定10.0mL浓度为0.1mol?L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法不正确的是( )| A、当V=0时:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-) |
| B、当V=5时:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-) |
| C、当V=10时:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| D、当V=a时:c(Na+)>c(Cl-)>c(H+)=c(OH-) |