题目内容
8.在标准状况下,a molCO2与b molSO2的分子数之比为a:b,电子数之比为11a:16b,质量之比为11a:16b;密度之比为11:16.分析 根据N=nNA计算出a molCO2与b molSO2的分子数、电子数之比,根据m=nM计算出二者质量之比;相同条件下气体的密度与摩尔质量成正比,据此计算出二者的密度之比.
解答 解:在标准状况下,a molCO2与b molSO2的分子数之比=物质的量之比=amol:bmol=a:b;含有电子数之比=(a×22):(b×32)=11a:16b;二者质量之比=(44g/mol×amol):(64g/mol×bmol)=11a:16b;
标准状况下,二氧化碳和二氧化硫气体的密度之比等于其摩尔质量之比=44g/mol:64g/mol=11:16,
故答案为:a:b;11a:16b;11a:16b;11:16.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与摩尔质量、阿伏伽德罗常数之间的关系即可解答,试题侧重基础知识的考查,有利于提高学生的化学计算能力.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
18.下列仪器需要垫石棉网加热的是( )
| A. | 试管 | B. | 蒸发皿 | C. | 容量瓶 | D. | 烧瓶 |
19.如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池.下列叙述正确的是( )

| A. | 该装置将电能转变为化学能 | B. | 锌片是正极 | ||
| C. | 一段时间后,铜片质量减轻 | D. | 电子从锌片流向铜片 |
16.在乙醇发生的下列反应里,存在乙醇分子中碳氧键断裂的是( )
| A. | 乙醇在浓硫酸存在的情况下与乙酸发生酯化反应 | |
| B. | 乙醇与金属钠反应 | |
| C. | 乙醇在浓硫酸作用下的消去反应 | |
| D. | 乙醇与O2的催化氧化反应 |
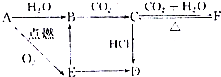
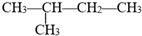 用系统命名法命名的名称是2-甲基丁烷,它的一氯代物有4种,若它是用烯烃和氢气加成而得到,则烯烃可能的结构简式是:CH2=(CH3)C-CH2-CH3;(CH3)2C=CH-CH3;(CH3)2CH-CH=CH2.
用系统命名法命名的名称是2-甲基丁烷,它的一氯代物有4种,若它是用烯烃和氢气加成而得到,则烯烃可能的结构简式是:CH2=(CH3)C-CH2-CH3;(CH3)2C=CH-CH3;(CH3)2CH-CH=CH2.