题目内容
19.如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池.下列叙述正确的是( )
| A. | 该装置将电能转变为化学能 | B. | 锌片是正极 | ||
| C. | 一段时间后,铜片质量减轻 | D. | 电子从锌片流向铜片 |
分析 该装置能自发的进行氧化还原反应,所以能构成原电池,锌易失电子发生氧化反应而作负极,铜作正极,电子从负极沿导线流向正极,电流流向与此相反,据此分析解答.
解答 解:A.该装置是将化学能转化为电能的装置,属于原电池,故A错误;
B.该装置中,锌易失电子作负极,铜作正极,故B错误;
C.铜作正极,正极上氢离子得电子生成氢气,所以铜片质量不变,故C错误;
D.该装置中,锌失电子发生氧化反应,电子从锌片流向铜,故D正确;
故选D.
点评 本题考查了原电池原理,明确原电池的判断方法、正负极的判断、正负极上发生的反应即可解答,难度不大.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
9.下列有关实验叙述正确的是( )
| A. | 氢氧化铁胶体制备:向沸水中逐滴加入少量饱和硫酸铁溶液,继续加热煮沸至液体变为红褐色,停止加热 | |
| B. | 用容量瓶配制溶液时,定容时俯视刻度线,所配溶液浓度偏大 | |
| C. | 中和热实验,在操作时应将碱液分多次倒入酸中,以防液体溅出,产生误差 | |
| D. | 萃取碘水中的碘实验时,将碘水倒入分液漏斗,然后再注入乙醇,振荡、静置分层后,下层紫色液体先从下口放出,之后,上层无色液体从上口倒出 |
10.能正确表示下列化学反应的离子方程式的是( )
| A. | 用碳酸钠溶液吸收少量二氧化硫气体:2CO32-+SO2+H2O═2HCO3ˉ+SO32- | |
| B. | 金属铝溶于盐酸中 Al+2H+═Al3++H2↑ | |
| C. | 硫化钠溶于水 S2-+H2O═H2S↑+2OH- | |
| D. | 碳酸镁溶于硝酸中 CO32ˉ+2H+═H2O+CO2↑ |
7.如图甲所示,纯电动公交车逐渐成为杭州街头常见的身影,磷酸铁锂电池是杭州市纯电动公交车所用的电池,现要从废旧磷酸铁锂电池中回收Fe、Al、Li等物质,采用下图乙所示方法.已知:磷酸铁锂电池溶解在中含有、等离子及少量不溶物,滤液c中含有大量离子,可溶于冷水,不溶于热水.

下列说法不正确的是( )

下列说法不正确的是( )
| A. | 向滤液a中加入适量溶液,可以得到白色沉淀 | |
| B. | 滤液b中加入氨水的目的是使沉淀,滤渣c为红褐色 | |
| C. | 要将Li从溶液中析出,可在滤液c中加入足量溶液,加热浓缩,冷却结晶 | |
| D. | 图中的氨水可以用适量NaOH溶液代替. |
9.下列说法中正确的是( )
| A. | 1molH2约含有6.02×1023个微粒 | |
| B. | 1mol任何物质都约含有6.02×1023个分子 | |
| C. | 32gO2和O3的混合气体中约含1.204×1024个氧原子 | |
| D. | 1mol氖气中约含有1.204×1024个氖原子 |
 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视. 是一种具有较好耐热性、耐水性和高频电绝缘性的高分子化合物(树脂),它是由三种单体在一定条件下缩聚(同时还生成水)而成的.这三种单体分别是(写结构简式)C6H5NH2、HCHO和
是一种具有较好耐热性、耐水性和高频电绝缘性的高分子化合物(树脂),它是由三种单体在一定条件下缩聚(同时还生成水)而成的.这三种单体分别是(写结构简式)C6H5NH2、HCHO和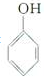 .它们的物质的量之比(按以上回答单体的顺序写)为1:2:1.
.它们的物质的量之比(按以上回答单体的顺序写)为1:2:1.