题目内容
10.下列说法正确的是( )| A. | 58.5gNaCl溶解于1L水中配成的溶液,该溶液的物质的量浓度为1mol/L | |
| B. | 将22.4L的HCl气体溶于水,制成1L溶液,其浓度为1mol/L | |
| C. | 配制480ml 1.0mol/L的NaOH 溶液需要NaOH 固体20.0g | |
| D. | 中和100ml 1 1mol/L 的H2SO4溶液,需要NaOH 4g |
分析 A、水的体积不等于溶液的体积;
B、没有告诉是标准状况下,题中无法计算氯化氢的物质的量;
C、配制480ml 1.0mol/L的NaOH 溶液,需要配制500ml1.0mol/L的NaOH 溶液计算所需溶质NaOH的质量;
D、根据H++OH-=H2O计算.
解答 解:A、水的密度与NaCl溶液的密度不等,则配制后溶液的体积不等于1L,无法计算,故A错误;
B、题中没有告诉是标况下,不能使用标况下的气体摩尔体积计算22.4LHCl气体的物质的量,故B错误;
C、配制480ml 1.0mol/L的NaOH溶液,需要配制500ml 1.0mol/L的NaOH溶液,所需溶质NaOH的质量=0.5L×1.0mol/L×40g/mol=20.0g,故C正确;
D、根据H++OH-=H2O,需要NaOH的物质的量为0.1L×1mol/L×2=0.2mol,质量为0.2mol×40g/mol=8g,故D错误.
故选C.
点评 本题考查物质的量浓度的计算,题目难度不大,注意水的密度与NaCl溶液的密度不等,水的体积不等于溶液的体积.

练习册系列答案
相关题目
10.以下名称、化学用语均正确的是( )
| A. | 笨的实验式:CH | B. | 二氯乙稀的结构简式:CH2=C(Cl)2 | ||
| C. | 甲酸的结构式: | D. | 醛基的电子式: |
1.(1)配制物质的量浓度为0.20mol•L-1NaOH溶液500mL,请回答下列问题(在横线上填上相应答案):
(2)在配制上述溶液时,下列哪个原因会造成所配溶液浓度偏高( )
A.所用NaOH已经潮解
B.向容量瓶中加水未到刻度线
C.有少量NaOH溶液残留在烧杯里
D.称量时误用“左码右物”
| 应称量NaOH的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器 |
| 4.0 | 500 | 烧杯、量筒、玻璃棒、药匙、托盘天平、胶头滴管 |
A.所用NaOH已经潮解
B.向容量瓶中加水未到刻度线
C.有少量NaOH溶液残留在烧杯里
D.称量时误用“左码右物”
18.NaCl在生产中有重要作用.
(1)某小组用NaCl进行以下实验:
①Ⅰ中白色沉淀的化学式是AgCl.
②Ⅱ中能说明沉淀变黑的离子方程式是2AgCl(s)+S2-(aq)=Ag2S(s)+2Cl-,沉淀能发生转化的主要原因是Ag2S比AgCl溶解度更小.
③经检测步骤Ⅲ中乳白色沉淀是AgCl和S的混合物.请写出黑色沉淀变为乳白色的化学方程式2Ag2S+O2+4NaCl+2H2O=4AgCl+2S+4NaOH,从化学平衡移动的角度解释在沉淀变色过程中NaCl的作用Ag2S被O2氧化生成S时释放出Ag+,NaCl中的Cl-与Ag+结合成AgCl沉淀,c(Ag+)减小,③中平衡向正反应方向移动,最终出现乳白色沉淀.
(2)电解法是治理铵盐为主要水体污染物的一种方法,原理是:在污水中加入一定量NaCl进行电解,产生的Cl2与水反应生成HClO,HClO 将NH4+氧化为N2,使水体脱氮.请写出酸性条件下HClO 与NH4+反应的离子方程式3HClO+2NH4+=N2↑+3Cl-+5H++3H2O.研究发现:污水呈弱酸性比强酸性更有利于使NH4+氧化为N2而脱氮,原因是酸性较强时,Cl2+H2O?H++Cl-+HClO 的化学平衡向逆反应方向移动,生成的HClO减少,不利脱氮.
(1)某小组用NaCl进行以下实验:
| 步 骤 | 现 象 |
| Ⅰ.将NaCl溶液与AgNO3溶液混合 | 产生白色沉淀 |
| Ⅱ.向所得固液混合物中加Na2S溶液 | 沉淀变为黑色 |
| Ⅲ.将Ⅱ中经过滤洗得到的黑色沉淀分成两份,在一份沉淀中加蒸馏水,另一份沉淀中加入NaCl溶液,同时浸泡较长时间. | 加蒸馏水的沉淀仍为黑色,加入NaCl溶液的沉淀变为乳白色 |
②Ⅱ中能说明沉淀变黑的离子方程式是2AgCl(s)+S2-(aq)=Ag2S(s)+2Cl-,沉淀能发生转化的主要原因是Ag2S比AgCl溶解度更小.
③经检测步骤Ⅲ中乳白色沉淀是AgCl和S的混合物.请写出黑色沉淀变为乳白色的化学方程式2Ag2S+O2+4NaCl+2H2O=4AgCl+2S+4NaOH,从化学平衡移动的角度解释在沉淀变色过程中NaCl的作用Ag2S被O2氧化生成S时释放出Ag+,NaCl中的Cl-与Ag+结合成AgCl沉淀,c(Ag+)减小,③中平衡向正反应方向移动,最终出现乳白色沉淀.
(2)电解法是治理铵盐为主要水体污染物的一种方法,原理是:在污水中加入一定量NaCl进行电解,产生的Cl2与水反应生成HClO,HClO 将NH4+氧化为N2,使水体脱氮.请写出酸性条件下HClO 与NH4+反应的离子方程式3HClO+2NH4+=N2↑+3Cl-+5H++3H2O.研究发现:污水呈弱酸性比强酸性更有利于使NH4+氧化为N2而脱氮,原因是酸性较强时,Cl2+H2O?H++Cl-+HClO 的化学平衡向逆反应方向移动,生成的HClO减少,不利脱氮.
19.下列分散系不能发生丁达尔现象的是( )
| A. | 豆浆 | B. | 鸡蛋清溶液 | C. | 食盐水 | D. | 淀粉溶液 |

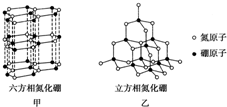 氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,只有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.
氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,只有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.