题目内容
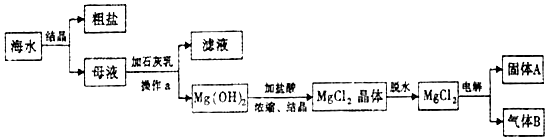
10.我国有广阔的海岸线,建设海峡经济区,海水的综合利用大有可为,如图所示为海水综合利用部分流程,有关说法正确的是( )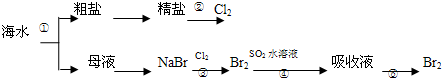
| A. | 上述工艺流程中涉及到化合、分解、复分解和置换反应 | |
| B. | ①只发生了化学变化,②是工业上用电解熔融NaCl制备Cl2 | |
| C. | ③④涉及的反应均为氧化还原反应,⑤只需要蒸馏即可得到单质Br2 | |
| D. | ④中反应的离子方程式为SO2+Br2+2H2O═4H++SO42-+2Br- |
分析 海水蒸发结晶得到粗盐和母液,粗盐精制得到精盐,胆碱熔融氯化钠生成氯气和金属钠,母液中通入氯气反应生成溴单质,热空气吹出被二氧化硫吸收得到溴化氢和硫酸,再通入氯气氧化溴化氢生成溴单质,富集溴,加入萃取剂萃取分液后蒸馏得到溴单质,
A.②是电解饱和食盐水,③是氯气和溴化钠反应生成溴单质,发生的是置换反应,④是二氧化硫和溴单质再水溶液中负氧化还原反应生成硫酸和溴化氢,加入萃取剂萃取分液后蒸馏得到纯溴;
B.海水蒸发水分结晶得到粗盐和母液,无化学变化,②利用电解熔融氯化钠得到氯气;
C.氧化还原反应中元素的化合价发生变化,⑤需要加入萃取剂萃取分液后,再蒸馏得到单质Br2;
D.根据反应④是二氧化硫被单质溴氧化生成硫酸和氢溴酸.
解答 解:A.②是电解熔融氯化钠,③是氯气和溴化钠反应生成溴单质,发生的是置换反应,④是二氧化硫和溴单质再水溶液中负氧化还原反应生成硫酸和溴化氢,加入萃取剂萃取分液后蒸馏得到纯溴,过程中无化合反应、复分解反应,故A错误;
B.流程分析可知海水蒸发水分结晶得到粗盐和母液,无化学变化,②利用电解饱和食盐水得到氯气,故B错误;
C.③⑤发生离子方程式为:2Br-+Cl2═Br2+2Cl-,④发生的离子方程式为:SO2+Br2+2H2O═4H++SO42-+2Br-,元素化合价都发生变化,属于氧化还原反应,⑤需要加入萃取剂萃取分液后,再蒸馏得到单质Br2,故C错误;
D.反应④是二氧化硫被单质溴氧化生成硫酸和氢溴酸,离子方程式为:SO2+Br2+2H2O═4H++SO42-+2Br-,故D正确;
故选D.
点评 本题主要考查了粗盐的提纯和物质的制备,涉及蒸发操作仪器、氧化还原反应判断、离子方程式书写等,注意基础知识的掌握,题目难度中等.

练习册系列答案
相关题目
1.下列溶液中,不能区别SO2和CO2气体的是( )
①石灰水 ②H2S溶液 ③KMnO4溶液 ④氯水 ⑤酸化的Ba(NO3)2溶液 ⑥品红溶液.
①石灰水 ②H2S溶液 ③KMnO4溶液 ④氯水 ⑤酸化的Ba(NO3)2溶液 ⑥品红溶液.
| A. | ①②③⑤ | B. | ②③④⑤ | C. | 只有① | D. | ①③ |
5.目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2 (g)+4H2(g)$\stackrel{Ru}{?}$CH4(g)+2H2O(g).已知H2的体积分数随温度的升高而增加.若温度从300℃升至400℃,重新达到平衡,下列各物理量的变化判断正确的是( )
| A. | 正反应速率减小 | B. | 逆反应速率增大 | ||
| C. | 平均相对分子质量不变 | D. | 转化率增大 |
15.某试液中只可能含有K+、NH4+、Fe2+、Al3+、CI-、SO42-、CO32-、AlO2- 中的若干种离子,离子浓度均为0.1mol•L-1.某同学进行了如下实验:下列说法正确的是( )
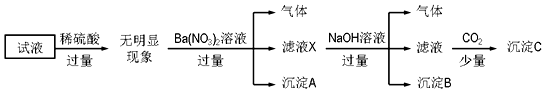

| A. | 原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42- | |
| B. | 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+ | |
| C. | 沉淀C为Al(OH)3 | |
| D. | 无法确定原试液中是否含有K+、Cl- |
2.下列有机物的命名正确的是( )
| A. | (CH3)2CHCH2CH3 2-甲基丙烷 | B. | (CH3)2C=CHCH3 2-甲基-2-丁烯 | ||
| C. |  2-丁烯 2-丁烯 | D. |  1,4-二甲苯 1,4-二甲苯 |
20.下列分子或离子中不能跟质子结合的是( )
| A. | NH3 | B. | H2O | C. | Ca2+ | D. | OH- |
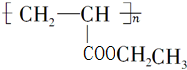 .
.