题目内容
17.下列反应的离子方程式书写正确的是( )| A. | 铁和稀硝酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 惰性电极电解熔融氯化钠:2Clˉ+2H2O$\frac{\underline{\;电解\;}}{\;}$2OHˉ+H2↑+Cl2↑ | |
| C. | 等体积等物质的度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+NH4++HCO32-+NH4+═BaCO3↓+NH3•H2O+H2O | |
| D. | 向FeCl3溶液中滴加KSCN溶液:Fe3++3SCN-═Fe(SCN)3↓ |
分析 A.稀硝酸具有强氧化性,铁与稀硝酸反应生成的是NO气体;
B.惰性电极电解熔融氯化钠生成的是金属钠和氯气;
C.二者物质的量相等,铵根离子和碳酸氢根离子都参与反应;
D.该反应为可逆反应,且不能使用沉淀符号.
解答 解:A.铁和稀硝酸反应没有氢气生成,若铁过量发生反应的子反应为:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,铁少量时的离子反应为:Fe+4H++NO3-═Fe3++NO↑+2H2O,故A错误;
B.惰性电极电解熔融氯化钠,反应生成钠和氯气,正确的反应为:2NaCl$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑,该反应不是发生中溶液中,不能书写离子方程式,故B错误;
C.等体积等物质的度的氢氧化钡与碳酸氢铵溶液混合,反应生成碳酸钡沉淀、一水合氨按和水,反应的离子方程式为:Ba2++2OH-+NH4++HCO3-+NH4+═BaCO3↓+NH3•H2O+H2O,故C正确;
D.反应生成的是络合物硫氰化铁,正确的离子方程式为:向FeCl3溶液中滴加KSCN溶液:Fe3++3SCN-?Fe(SCN)3,故D错误;
故选C.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度不大,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
7.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 136g熔融的KHSO4中含有2NA个阳离子 | |
| B. | 40gH218O与40gD2O所含的中子数均为20NA | |
| C. | 1molFe分别与足量的稀硫酸和稀硝酸反应转移电子数均为2NA | |
| D. | 标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为NA |
5.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 无色中性溶液中:Na+、K+、CO32-、SO42- | |
| B. | 含有大量Fe3+的溶液中:Na+、Mg2+、NO3-、I- | |
| C. | 加入铝粉后有气体放出的溶液:Fe2+、K+、NO3-、Cl- | |
| D. | 能使酚酞变红色的溶液:CO32-、Cl-、F-、K+ |
12.固体醋酸钠与浓硫酸混合加热,蒸馏得到的馏出物是( )
| A. | 水 | B. | 甲烷 | C. | 乙酸 | D. | 硫酸钠 |
6.下列属于原子晶体的化合物是( )
| A. | 干冰 | B. | 晶体硅 | C. | 金刚石 | D. | 碳化硅 |
5.目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2 (g)+4H2(g)$\stackrel{Ru}{?}$CH4(g)+2H2O(g).已知H2的体积分数随温度的升高而增加.若温度从300℃升至400℃,重新达到平衡,下列各物理量的变化判断正确的是( )
| A. | 正反应速率减小 | B. | 逆反应速率增大 | ||
| C. | 平均相对分子质量不变 | D. | 转化率增大 |
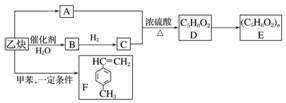
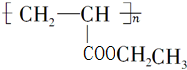 .
.
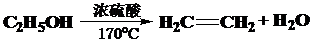 .
. .
.